الفلزات Metals
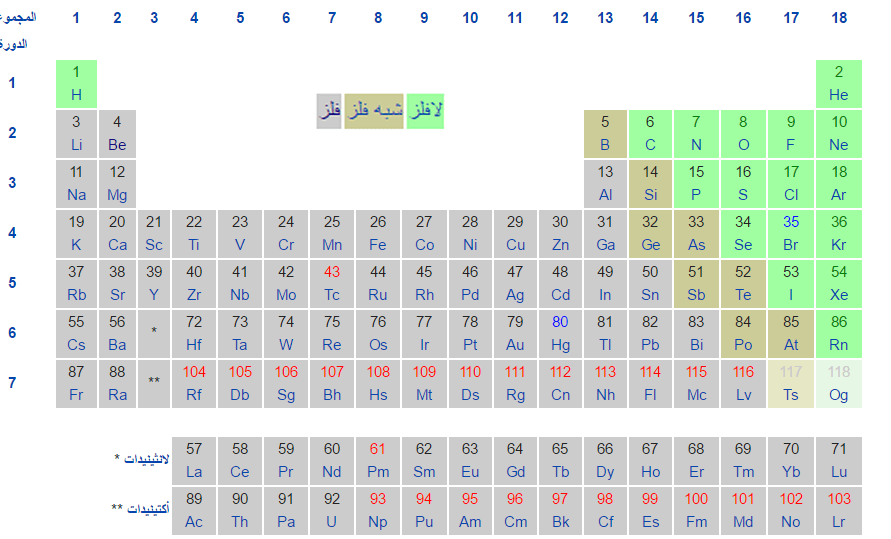
تقسيم العناصر الكيميائية
قسم العالم برزيليوس Berzelius العناصر في بداية القرن التاسع عشر إلى ثلاث أقسام رئيسيه قبل أن يعرف أي شيء عن بنية الذرة وهذه الأقسام هي: الفلزات – اللافلزات – أشباه الفلزات.
(1) الفلزات Metals
– هي عناصر يقل عدد الالكترونات في مستوى طاقتها الخارجي عن 4 الكترونات في الغالب.
– تميل إلى فقد الكترونات تكافؤها لتكون أيونات موجبة.
– تحمل عدداً من الأيونات الموجبة يساوى عدد الالكترونات المفقودة.
– يشبه تركيب الأيون الموجب تركيب الغاز الخامل الذي يسبقه في الجدول الدوري.
(2) اللافلزات Non-metals
– تتميز عناصر اللافلزات باحتواء مستوى طاقتها الخارجي على أكثر من أربع الكترونات في الغالب.
– تميل ذرات اللافلزات لاكتساب الكترونات لتكمل مستوى طاقتها الخارجي مكونة أيون سالب.
– يحمل عدداً من الشحنات السالبة يساوى عدد الالكترونات المكتسبة.
– يشبه التركيب الالكتروني للأيون السالب تركيب الغاز الخامل الذي يليه.
(3) أشباه الفلـزات Metalloid
– هي عناصر تجمع في خواصها بين الفلـزات واللافلزات ولكنها اقرب للفلزات.
– يصعب التعرف عليها من تركيبها الإلكتروني لاختلاف أعداد الالكترونات في أغلفة تكافؤها.
– أشباه الفـلزات هي البورون والسيلكون والجرمانيوم والزرنيخ والانتيمون والتيلوريوم.
وفى هذا الدرس أن شاء الله سوف نتكلم عن الفلزات فقط.
تعريف الفلزات
– الفلزات هي العناصر الكيميائية التي تفقد الالكترونات لتكون أيونات موجبة وتجد رابطة فلزية بين ذراتها.
– كما يتم وصف الفلزات أيضا على أنها شبكة من الأيونات الموجبة داخل سحابة من الالكترونات.
– تشكل الفلزات 75 % من العناصر .
– توجد جميع الفلزات في الحالة الصلبة إلا الزئبق يوجد في الحالة السائلة .
– أقوى الفلزات في الجدول الدوري يقع أسفل يسار الجدول وهو السيزيوم.
– تعلم أن في الجدول الدوري ( 8 ) مجموعات تجد :
- جميع عناصر المجموعة الأولى والثانية فلـزات.
- جميع عناصر المجموعة السابعة والثامنة لافلزات.
- عناصر المجموعات ( 3 – 6 ) تحتوي على فلـزات ولافلزات وأشباه فلزات.
مكان وجود الفلزات
– توجد بعض الفلـزات مثل : الذهب والنحاس والفضة في الصخور كعناصر حرة .
– معظم الفلـزات لها واحد أو اثنين أو ثلاثة الكترونات في الغلاف الخارجي قابلة للمشاركة بسهولة مع ذرات أخرى.
– ترتبط ذرات الفلـزات مع بعضها برابطة فلزية.
– ذرات الفلـزات تكون متلاصقة فأن الكترونات هذه الذرات تكون سحابة تدور حول هذه الذرات.
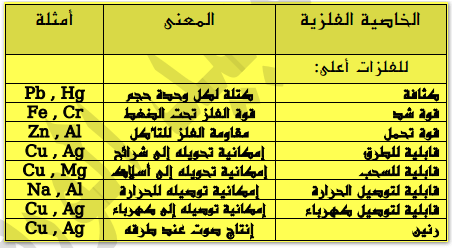
الخواص العامة للفلزات
تتميز الفلـزات ببعض الصفات كما يلي:
- تمتاز بلمعانها وبريقها.
- لها كثافة مرتفعة.
- قابلة للطرق والسحب.
- تحتاج لدرجة انصهارٍ عاليةٍ جداً.
- تُعتبر من المواد جيدة التوصيل للكهرباء والحرارة.
- يسهل تشكيل العناصر الفلزيّة وسكبها في قوالب نظراً لطراوتها.
- تُصنّف معظم عناصر الفلـزات على أنّها غير مستقرة كيميائيّاً؛ حيث تتفاعل بسرعة مع الأكسجين الموجود في الهواء وبالتالي تتأكسد.
- تُعتبر الفلزات القلويّة من أكثر أنواع العناصر تفاعلاً.
الخواص الطرفية للفلزات
- الفلز الأخف وزنا: الليثوم Li
- الفلز الأثقل وزناً: الأوزميوم Os
- الفلـز الأكثر هشاشة: المنجنيز Mn
- الفلز أكثر قابلية للتقصف: الكروم Cr
- الفلز الأعلى ثمناً: البلاتين Pt
- الفلـز الأكثر ندرة: الروديوم ( Rh أندر فلز طبيعي في الأرض )
- الفلز الأكثر وفرة: الألومنيوم Al يشكل أكثر من 8 % من القشرة الأرضية.
- الفلـز الأدنى درجة إنصهار: الزئبق Hg
- الفلز الأعلى درجة إنصهار: تنجستن W
وهذه قائمة بالخصائص الفيزيائية للفلـزات الأعلى كما يلي:
أهمية بعض العناصر الفلزية
- الحديد : في صناعة السيارات وأعمال البناء.
- النحاس: في صناعة أواني الطبخ، وهياكل السيارات، وصناعة سبائك البرونز، إضافةً إلى صناعة أسلاك الكهرباء.
- الألمنيوم : في صناعة الأواني المنزلية
- الذهب والفضة : في صناعة الحلي والمجوهرات إضافة إلى صك العملات، وصناعة الإلكترونيّات.
- القصدير : صناعة العلب لكى لا تصدأ
تدرج الصفة الفلزية في الجدول الدوري
في الدورات الأفقية:-
تقل الصفة الفلزية كلما اتجهنا من اليسار إلى اليمين أي بزيادة العدد الذرى ونقص نصف القطر حتى تظهر أشباه الفلـزات ثم تزداد الصفة اللافلزية وتنتهى الدورة بغاز خامل. ( في الدورة أقوى الفلزات يقع في المجموعة الأولى وأقوى اللافلزات يقع في المجموعة السابعة)
في المجموعات الرأسية:-
تزيد الصفة الفلزية وتقل الصفة اللافلزية كلما اتجهنا من أعلى إلى أسفل أي بزيادة العدد الذرى وكبر نصف القطر.
تعريفات هامة خاصة بالفلزات
(1) الفلزات القلوية
– تشمل عناصر المجموعة الأولى في الجدول الدوري حيث تتكون من ستة عناصر شديدة التفاعل.
– سميت بهذا الاسم لأنها تتفاعل مع الماء منتجةً محاليل قلوية.
– تتميز بأنها لامعة – صلبة – منخفضة الكثافة ودرجات الانصهار.
– يزداد نشاطها كلما نزلنا في المجموعة الأولي للأسفل وذلك بسبب ازدياد حجمها مما يسبب بضعف قوة جذب النواة فيسهل فقدها للإلكترونات.
– من أهم استخداماتها كما يلي:
- الليثيوم: يستخدم في بطاريات الليثيوم المستخدمة في الهواتف النقالة والكاميرات.
- الصوديوم: موجود في ملح الطعام ( كلوريد الصوديوم).
- الصوديوم والبوتاسيوم: ضروريان للأجسام وهما موجودان بكميات قليلة في البطاطس والموز.
(2) الفلزات القلوية الأرضية (الترابية)
– تشمل عناصر المجموعة الثانية في الجدول الدوري وتتكون من 6 عناصر.
– تعرف بأنها أكثر صلابة وكثافة وأعلى درجات انصهار من الفلـزات القلوية.
– نشطة كيميائيا لكنها بدرجة أقل من الفلـزات القلوية.
– وجودها في الطبيعة: البريليوم في الزمرد والزبرجد والماغنيسيوم موجود في كلوروفيل النباتات.
(3) الفلزات الانتقالية
– تشمل أي عنصر من عناصر المستوي الفرعي (d) في الجدول الدوري
– تميل العناصر الانتقالية لأن يكون لها كثافة، درجة حرارة غليان ودرجة حرارة ذوبان عالية. وكما يوجد في كثير من الفلزات الانتقالية، فإن هذا يرجع إلى قدرة إلكترونات المدار (d) على إعادة التمركز. فالمواد الفلزية، كلما زادت فيها الإلكترونات المشاركة بين النويات، كلما كان الفلز أقوى.
– يوجد عدة خواص عامة للفلزات الانتقالية من أهمها كما يلي:
- تكون مركبات ملونة.
- يمكن أن يكون لها أكثر من حالة تأكسد.
- عوامل حفازة جيدة.
- لونها فضي يميل إلى الأزرق في درجة حرارة الغرفة، فيما عدا النحاس والذهب.
- كلها صلبة في درجة حرارة الغرفة فيما عدا الزئبق.
- يمكن أن تكون مركبات معقدة، والتي يتم وصفها في نظرية الحقل البلوري.
(4) فلـزات حديدية
هي الفلـزات التي تحتوي على الحديد.
(5) فلـزات خاملة
هي تلك التي تقاوم الأكسدة والتآكل قد. من الممكن إدراجها كفلزات نفيسة. مثل التانتالوم والبلاتين
(6) فلـزات نفيسة
هي فلـزات لها قيمة اقتصادية عالية. تعتبر كيميائيا فلزات أقل نشاطا من الفلزات الأخرى، أكثر لمعاناً وتوصيلاً للكهرباء. وكانت تاريخيا تستخدم كعملة، لكن الآن تعد أساس الاستثمار والسلع الصناعية مثل الذهب، والفضة، والبلاتين.
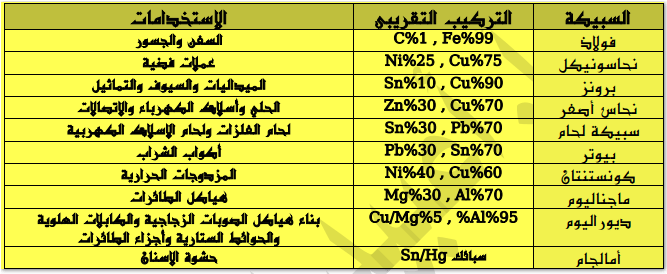
(7) السبائك
– السبيكة هي خلط فلز مع أخر أو أكثر بنسب معينة بغرض تحسين خواصه وتحتوى على الأقل عنصر فلزي واحد حيث تمنع إضافة فلز آخر بكميات قليلة الذرات من الانزلاق فوق بعضها ومن ثم تكون السبيكة الناتجة ( أقوى وأصلب وأقل عرضة للأعوجاج)
– وهذه قائمة بأغلب السبائك الشائعة كما يلي:
صور لبعض الفلزات
اقرأ إيضاً: الرابطة الفلزية والخواص الفيزيائية للفلـزات