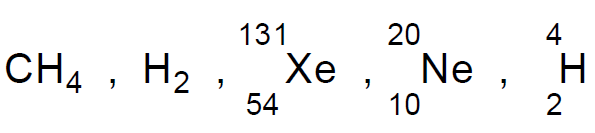الترابط الجزيئي Molecular bonding
محتويات الموضوع
تعريف الترابط الجزيئي Molecular bonding
– الترابط الجزيئي Molecular bonding هو القوي التي تربط بين الجزيئات والتي تحدد كثير من الخواص الفيزيائية للمركبات مثل الحالة الفيزيائية ودرجة الغليان والانصهار وغيرها.
– تنقسم قوى الترابط بين الجزئيات كما يلي:
- قوى فاندر فال Van der Waals forces
- القوى بين الجزيئات القطبية Dipole-dipole forces
- الروابط الهيدروجينية Hydrogen bonds
قوى فاندر فال (قوى لندن)
– في لحظة ما قد يكون التوزيع الإلكتروني في الجزئ غير منتظم نتيجة لحركة الإلكترونات وبالتالي تكون الشحنة الكهربية غير منتظمة بحيث تكون الكثافة الإلكترونية في أحد أطراف الجزئ أعلى قليلا فتؤدي إلى استقطاب بسيط يتكون بصورة مؤقتة (استقطاب لحظي).
– يؤثر الجزئ المستقطب لحظياً على السحابة الإلكترونية لجزئ أخر مجاور فيتكون في الطرف القريب منها شحنة مضادة.
– وأثناء وجود هذه التغيرات القطبية تنشأ قوي تجاذب بين الجزيئات غير القطبية.
– وتعتمد هذه القوي على استجابة الإلكترونات للتغيرات في المجال الكهربي وهو ما يعرف بالاستقطاب النسبي لإلكترونات الذرات.
– يعتمد الاستقطاب النسبي للإلكترونات على قوة جذب النواة لها.
– فعلى سبيل المثال نجد مجموعة الهالوجينات يزداد استقطابها من أعلى الى أسفل F < Cl < Br < I وذلك لأن إلكترونات الفلور مشدودة بقوة كبيرة نحو النواة بينما إلكترونات اليود على العكس من ذلك.
سؤال (1): لماذا يكون استقطاب إلكترونات الهالوجينات أكثر من استقطاب مجموع الألكيل المقاربة لها في الحجم؟
الحل:
– وذلك بسبب وجود إلكترونات غير رابطة في ذرات الهالوجينات فيكون استقطابها أسهل من استقطاب الإلكترونات الرابطة.
القوى بين الجزيئات القطبية
هي القوي الناشئة عند أقطاب الجزئيات المستقطبة استقطاب دائم والناتج عن التوزيع الغير المنتظم لإلكترونات الروابط وهذا النوع من القوى يكون أقوى بكثير من قوى فاندرفال.
سؤال (2): أي مما يلي له درجة غليان أعلى ولماذا ؟
الحل:
– يمتلك غاز (Xenon (Xe أعلى درجة غليان لأن قوى فاندرفال بين ذراته أكبر بسبب كبر حجم الذرة الذي يؤدي إلى ابتعاد الإلكترونات عن النواة.
الروابط الهيدروجينية
– الرابطة الهيدروجينية هي أحد قوي الترابط الجزيئي المهمة.
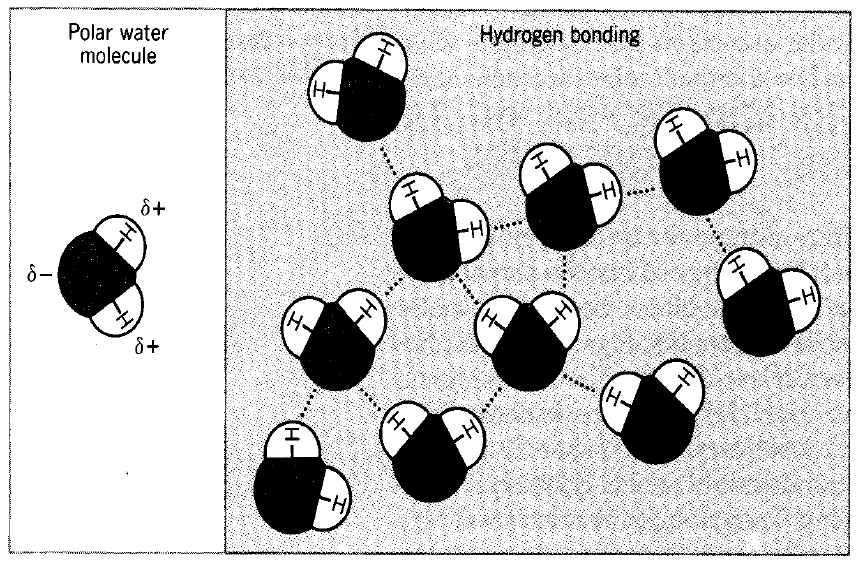
– الرابطة الهيدروجينية هي رابطة تنشأ عندما تتواجد ذرة الهيدروجين بين ذرتين لهما كهروسالبية عالية وتحمل أزواج إلكترونية غير رابطة (N , O , F) بشرط أن تكون مرتبطة مع إحداها تساهمياً.
– تنشأ قوى تجاذب قطبية بين ذرة الهيدروجين وأزواج الإلكترونات غير الرابطة التي تحملها الذرة الأخرى.
– فمثلاً الروابط الهيدروجينية في جزئ الماء تتكون بعد تهجين الأفلاك في ذرة الأكسجين وتكوين جزئ الماء حيث يبقى فلكان sp3 الممتلئان غير الرابطان على ذرة الأكسجين وهما المسئولان على تكوين الرابطة الهيدروجينية.
ملاحظات هامة
(1) تفسر الروابط الهيدروجينية ارتفاع درجة غليان الماء على الرغم من انخفاض وزنه الجزيئي كذلك تحافظ على المسافات البينية بين جزيئاته فتجعل الثلج أقل كثافة من الماء.
(2) إن حمض Hydrofluoric HF في الماء حمض ضعيف. بسبب الروابط الهيدروجينية الضمنية (بين جزيئاته) تتأين هاليدات الهيدروجين الأخرى تأين كامل في الماء.
(3) إن الروابط الهيدروجينية أضعف من الروابط التساهمية وأطول منها بمقدار الضعف تقريبا ولكنها أقوى من القوى القطبية مثل تلك التي في جزئ CH3Cl وهذه الأخيرة أقوى من قوي فاندرفال.
المصادر: أسس الكيمياء العضوية Foundations of Organic Chemistry للمؤلف وائل غالب محمد – وليد محمد السعيطي.