النظائر المشعة والعناصر المشعة
– قبل أن نتكلم فى موضوع الدرس سوف نستطرق بإختصار إلي النشاط الإشعاعي والعناصر المشعة والنظائر المشعة.
محتويات الموضوع
ما هي النظائر Isotopes ؟
– إن نواة أي عنصر تتحدد برقمه الذرى، وتحتوى دائماً على ذات العدد من البروتونات، ولكنها قد تختلف من حيث عدد النيوترونات، و بالتالى يمكن أن تكون مختلفة الكتل، (أي تختلف أرقامها الكتلية).
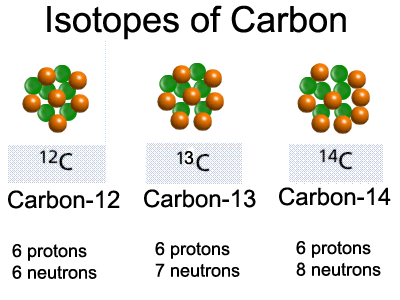
– إن النيوكليدات التي تختلف فقط فى رقم كتلتها، وليس بالرقم الذرى، تسمى نظائر.
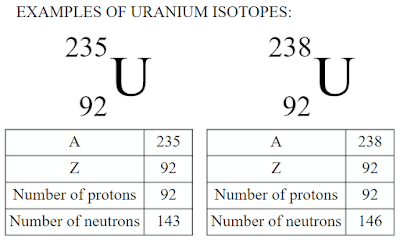
– فإن هناك – على سبيل المثال عدة نيوكليدات تحمل ذات الرقم الذرى (92)، وجميعها تعرف باليورانيوم، إلا أن رقم كتلتها تتراوح ما بين 227 إلى 240 ويشار إليها مثلاً باليورانيوم 233، اليورانيوم 235 اليورانيوم 238…إلخ.
– وبالقياس فإن الهيـدروجين 1 ، الهيدروجـين 2 أو الديتريـوم، والهيدروجين 3 أو الترتيوم تعتبر نظائر للهيدروجين.
– إن العامل الأساسي للتصرف الكيميائي لعنصر معين هو كمية الشحنة الكهربائية الموجبة فى النواة (عدد البروتونات)؛ ويحدد ذلك عدد الإلكترونات المدارية، التي تؤثر فعليا فى الخواص الكيميائية للعنصر.
– إن النظائر المختلفة لعنصر معين، والتي تحمل نواتها نفس الشحنة الكهربائية ولكن تختلف كتلتها، تتصف بخواص كيميائية متماثلة، لكن تختلف الخواص الفيزيائية الخاصة بها من نظير لآخر.
– تتكون العناصر الكيميائية إما من نواة مفردة (عناصر مفردة النظائر)، أو من خليط مكون من نظيرين أو أكثر بنسب ثابتة معروفة.
– فعلى سبيل المثال فإن الكلور الطبيعي – فى حالته النقية أو المتحدة يتكون دائماً من خليط من كلور 35 بنسبة 75.4% ومن كلور 37 بنسبة 24.6% (والذي يعطيه وزنه الذرى 35.457).
– عندما يكون هناك عنصر مكون من خليط من النظائر يمكن فصل أجزائه المكونة بعملية الصهر من خلال أنابيب مسامية على سبيل المثال، أو بفصل كهربائي مغناطيسي، أو بتحليل كهربائي تجزيئي.
– ويمكن أيضاً الحصول على النظائر بقذف العناصر الطبيعية النيوترونات، أو جزيئات محملة بطاقة حركية عالية.
النظائر المشعة الصناعية
– عبارة (النظائر) لا تشمل النظائر في حالتها النقية فحسب، لكن تشمل أيضاً العناصر الكيميائية التي تم تعديل تركيبها النظائرى الطبيعي صناعياً، وذلك بجعل العناصر غنية فى بعض النظائـر (وهو نفس ما يحدث عند تخفيض بعض النظائـر فى عناصر أخرى)، أو بتحويل بعض من نظائرها إلى أخرى اصطناعية من خلال التفاعلات النووية.
– ومثال ذلك الكلور ذو الوزن الذرى 35.30. والمتحصل عليه بجعل ذلك العنصر غنياً بحيث يحتوى على 85% من الكلور 35. (و بالتالي بتخفيضه لكي يحوى نسبة %15 فقط من (الكلور37) الذى يعتبر من النظائر.
– وتجدر ملاحظة أن العناصر التى توجد فى الطبيعة بحالة نظائرية أحادية. مثل البريليوم 9، الفلور 19، الألومنيوم 27، الفوسفور 31، المنجنيز 55.. الخ. لا يعتبر نظائر، لكنها تبند فى أى من حالتها الحرة أو المتحدة – حسب الحالة – ضمن بنود أكثر تخصيصا ينتمي إليها العنصر الكيميائي أو المركب الكيميائي.
– من ناحية أخرى، فإن النظائر المشعة لذات العناصر المتحصل عليها إصطناعياً (مثل البريليوم 10، (Be-10) فلور 18 (F-18) ألومنيوم 29 (AI-29) والفوسفور 32 (P-32) منجنيز 54 (Mn-54) تعتبر من النظائر.
– وحيث أن العناصر الكيميائية الإصطناعية (التى تزيد أرقامها الذرية عادة عن 92 أو العناصر الإنتقالية) ليس لها تركيب نظائرى ثابت، بل ويختلف حسب طريقة الحصول على العنصر.
ما هو النشاط الإشعاعي ؟
– بعض الينوكليدات، بحكم تكوين نواتها غير المستقر، تصدر إشعاعات مشتركة، سواء أكانت بحالتها النقية أو بشكل مركبـات كيميائية.
– وبإمكان هذه الإشعاعات أن تحدث تأثيرات فيزيائية أو كيميائية، مثل:
- تأين الغازات
- إستضاءة
- التأثير على الألواح الفوتوغرافية
– تمكن هذه التأثيرات من إكتشاف هذه الإشعاعات. كما يمكن قياس حدتها بإستخدام عدادات جيجر مولر مثلاً، أو عدادات تناسبية أو غرف تأبين أو غرف ولسون أو عدادات تدفق الفقاعات أو عدادات الومض أو أشرطة وألواح محسسة وتعرف هذه الظاهرة بالنشاط الإشعاعي.
– وتعرف العناصر الكيميائية والنظائر والمركبات وبصفة عامة المواد التي تظهر هذا النشاط تسمى (مشعة).
العناصر المشعة Radioactive elements
– العناصر المشعة وتشمل العناصر الآتية كما يلي:
- التكنيتيوم
- البروميثيوم
- البولونيوم
- الأستانين
- الرادون
- الفرنسوم
- الراديوم
- الأكتينيوم
- التوريوم
- البروتاكتنيوم
- اليورانيوم
- النبتـونيوم
- البلوتونيوم
- الأريسيوم
- الكلوريوم
- البركليوم
- الكالينورنيوم
- الأينشتانيوم
- الفيرميوم
- المندلينيوم
- النوبليوم
- اللورنسيوم.
– تتكون هذه العناصر عامة من نظائر عديدة جميعها مشعة.
– وعلى خلاف ذلك فإن، هناك عناصر تتكون من مزيج من نظائر مستقرة ومشعة كما يلي:
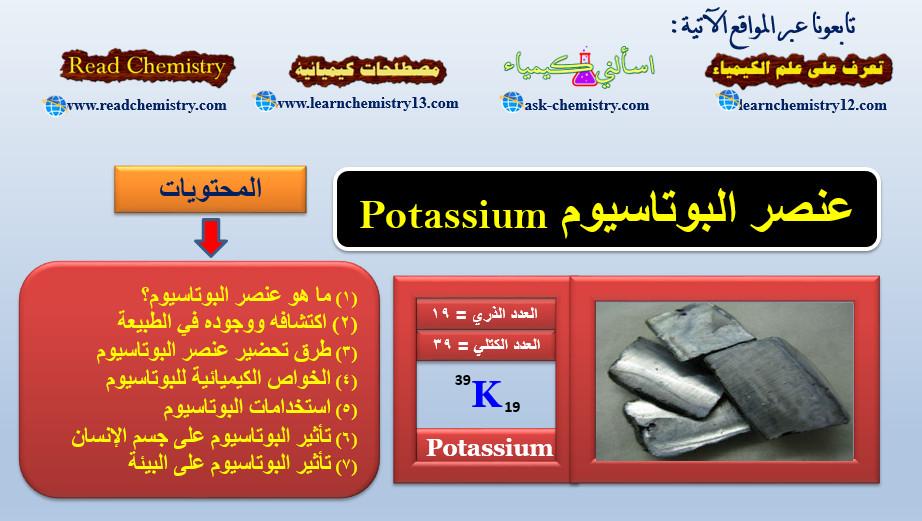
- البوتاسيوم
- الروبيدوم
- الساماريوم
- اللوتيتيوم
– والتى تتميز نظائرها المشعة بقلة مستوى إشعاعها. وبأنها تشكل نسبة منخفضة نسبيا فى المزيج، لذا فإنها تعتبر ثابتة علمياً، وبالتالي فإنها لا تخضع لهذا البند.
– ومن جهة أخرى، فإن ذات هذه العناصر (البوتاسيوم، الروبيديوم، الساماريوم، واللوتيتيوم)، إذا ما أصبحت غنية بنظائرها المشعة (بوتاسيوم 40 (K 40)، روبيديوم 87 (Rb 87)، ساماريوم 147 (Sm 147) لوتيتيوم 176 (Lu 176) على التوالى) فإنها تعتبر من النظائر المشعة الداخلة فى هذا البند.
النظائر المشعة Radioactive isotopes
– من بـين النظائر المشعـة الطبيعية، يمكن ذكر البوتاسيوم 40 والروبيديوم 87 والساماريوم 147 واللوتيسيوم 176 والتي سبق ذكرها أنفا، فضلاً عن اليورانيوم 235 واليورانيوم 238 وبعض نظائر الثاليوم والرصاص والبزموت والبولونيوم والراديوم والأكتينيوم والثوريوم والمعروفة غالباً بتسمية تختلف عن تسمية العنصر المقابل.
– وتشير تلك التسمية إلى العناصر المشتقة منها بعملية التحويل الإشعاعى.
– وبناء عليه فإن البزموت 210 يسـمى راديـوم (E) والبولونيـوم 212 يسمى ثوريوم (C) والأكتينيـوم 228، يسـمى ميزوثوريوم II.
– ثمة عناصر كيميائية، مستقرة عادة، يمكن أن تصبح مشعة إمـا بعد أن تكون قذفت بجزيئات مشحونة بطاقة حركية عالية جداً (بروتونات، ديوترونات) صادرة عن جهاز لتسريع الجزيئات (سيكلوترون، سنكروترون. ..إلخ)، أو مابعد أن تكون أمتصت نيوترونات فى مفاعل نووى .
– والعناصر التى لحقها مثل هذا التحول تسمى نظائر مشعة إصطناعياً. ويعرف منها حتى الآن زهـاء 500 نظير، مائتان منها تقريباً لها تطبيقات عملية، فبخلاف نظائر اليورانيـوم 233 ونظائر البلوتونيوم، التى سبق ذكرها نذكر أكثرها أهمية وهى الهيدروجين 3 (تريتيوم)، الكربون 14، الصوديوم 24، الفوسفور 32، الكبريت 35، البوتاسيوم 42، الكالسيوم 45، الكروم 51، الحديد 59، الكوبالت 60، الكريبتون 85، الإسـتروتنيتوم 90، الأيتريوم 90، البلاديوم 109، اليود 131 و 132، الزينـون 133، السيزيوم 137، الثوليوم 170، الإيرديوم 192، الذهب 198، والبولونيوم 210.
– إن العناصر الكيميائية المشعة والنظائر المشعة، تتحول ذاتياً بصورة طبيعية إلى عناصر أو إلى نظائر أكثر ثباتاً أو إستقراراً.
– إن الفترة الزمنية اللازمة كى تتناقص كمية نظير مشع معينة إلى نصف ما كانت عليه فى البداية، فإنها تسمى فترة التحول أو نصف حياة ذلك النظير. وتتراوح بين جزء من الثانية لبعض النظائـر المشعة وحتى بلايين السنين وتشكل هذه الفترة الزمنية مقياساً معيارياً مناسباً لقياس عدم الإستقرار إحصائياً للنوبات الخاصة بالنظير.
– تدخل فى هذا البند العناصر الكيميائية والنظائر المشعة حتى ولو كانت مختلطة ببعضها أو بمركبات مشعة، أو بمواد غير مشعة. (مثلاً أهداف غير معالجة ولحقها إشعاع، ومصادر مشـعة)، شريطـة أن يزيـد النشاط الإشعاعي النوعي لها عن 0.002 ميكروكورى (74B9/G).