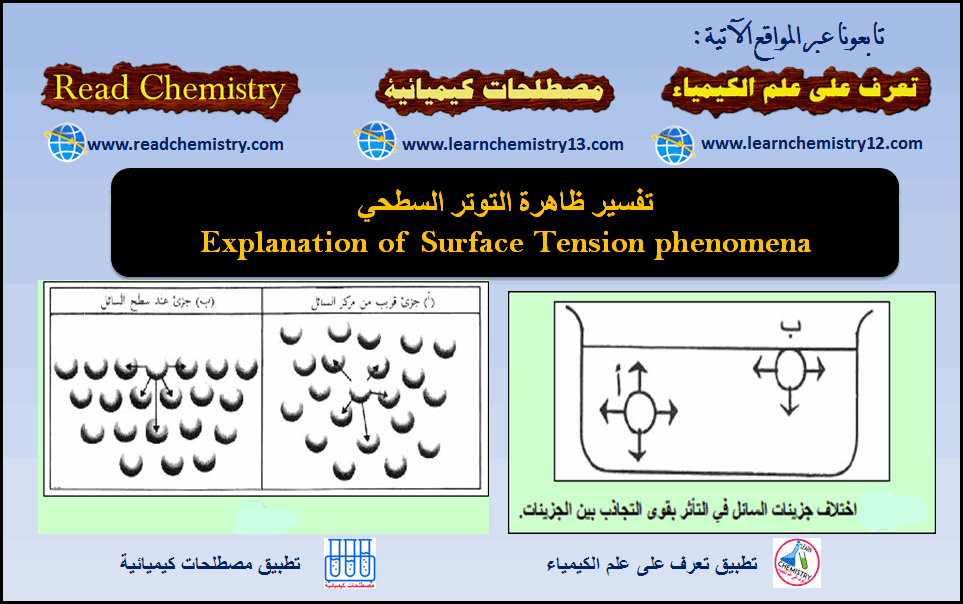
الكيمياء الفيزيائية
قائمة بأهم موضوعات الديناميكا الحرارية (الثيرموديناميك)

مقدمة عن الديناميكا الحرارية Introduction of Thermodynamic
– توجد أنواع كثیرة من الطاقة مثل الطاقة الحراریة، الطاقة الكھربیة، الطاقة المیكانیكیة، الطاقة الكیمیائیة، الطاقة المغناطیسیة، الطاقة الحركیة والطاقة السطحیة وغیر ذلك وتحت ظروف معینة یمكن لھذه الأنواع من الطاقة أن تتحول الى بعضھا البعض، وتھتم الدینامیكا الحراریة بالبحث عن العلاقة بین ھذه الأنواع المختلفة من الطاقة كما تھتم بانتقال الحرارة وكذلك الشغل المصاحب لبعض العملیات الكیمیائیة والفیزیائیة.
– یتكون مصطلح Thermodynamic من مقطعین، ھما كلمة (ثيرمو (Thermo أي الحرارة وكلمة (دینامیك dynamic) أي المتحرك.
– الثیرمودینامیك: علم یھتم بدراسة الطاقة وتحولاتھا، ویھدف نحو تحویل أكبر مقدار من الطاقة الحراریة الناتجة من احتراق الوقود الى طاقة میكانیكیة، بمعنى آخر : تحسین كفاءة المحرك.
– بني ھذا العلم على أساس التجربة الإنسانیة الكبرى أن الطاقة موجودة، ولا یمكن خلقھا أو فناؤھا. ومن ھذه الحقیقة أمكن استنباط علاقات ریاضیة مختلفة بین خواص المادة، التي تنطوي على امتصاص للحرارة.
– تعتمد دراسة الدینامیكا الحراریة أساساً على ثلاثة تعمیمات، تعرف بالقوانین الثلاثة للدینامیكا الحراریة، وھي: القانون الأول، والقانون الثاني، والقانون الثالث للدینامیكا الحراریة. وھذه القوانین الثلاثة لا تعتمد على أي نموذج أو أي نظریة خاصة بالتركیب الذري أو الجزیئي أو بطبیعة المادة، ولذلك فإن أي تطور یحدث في الأفكار والنظریات الحالیة الخاصة بطبیعة الجزیئات لن یؤثر بأي طریقة على صحة أي نتیجة دینامیكیة حراریة.
فوائد علم الديناميكا الحرارية Importance of Thermodynamic
– یجیب علم الثیرمودینامیك على أسئلة مھمة مثل:
(1) لماذا تحدث التفاعلات الكیمیائیة؟
(2) لماذا تحدث بعض التفاعلات تلقائیاً حتى اكتمالھا، والبعض الآخر تتم جزئیاً وتفاعلات أخرى لا تحدث أبداً عند نفس الظروف؟
(3) ما ھي تغیرات الطاقة المصاحبة للتفاعلات الكیمیائیة سواءً في التفاعلات نفسھا أو في الوسط المحیط بھا؟
– علم الثیرمودینامیك علم لا یھتم بعامل الزمن في التفاعلات، فھو ینبيء فقط فیما إذا كان تغیر كیمیائي معین (أو بصورة عامة تغیر ما) قابل للحدوث أم لا دون أن یبین سرعة حدوث ھذا التغیر. فربما یكون التفاعل تلقائیاً ویحدث ببطء شدید كصدأ الحدید مثلاً. وبعض التفاعلات قد یحتاج لحث بسیط لحدوثھا كاحتراق الھیدروجین مع الأكسجین حیث لا یبدأ التفاعل إلا في وجود شرارة وقود. ومن صفات التفاعلات التلقائیة أنھا غیر انعكاسیة حیث لا یمكن تفكیك جزيء الماء مثلاً بعد تكوینه.
تلقائية التفاعل Spontaneity of Reaction
– یعد علم الدینامیكا الحراریة (الثیرمودینامیك) أحد فروع علم الكیمیاء المھمة، والذي یمكن بواسطته دراسة (بشكل نظري) إمكانیة حدوث تفاعل كیمیائي من عدمه، أي أنه دون إجراء التجربة العملیة یمكن أن نقرر ما إذا كانت مادتان كیمیائیتان ستتفاعلان تلقائیاً أم لا، مما یوفر كثیراً من الوقت والجھد والكلفة.
– فباستخدام المبدأین العلمیین المعروفین بالقانون الأول والقانون الثاني للدینامیكا الحراریة، یستطیع الكیمیائیون إقرار ما إذا كان ھناك تفاعل كیمیائي سیحدث (یمكن حدوثه بطریقة تلقائیة في الظروف العادیة)، وإقرار المدى الذي یبلغه ھذا التفاعل.
– على سبیل المثال، تحضیر النشادر (الأمونیا) في الصناعة بتفاعل غازي الھیدروجین والنيتروجين طبقاً للعلاقة:
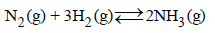
وباستخدام جداول الكیموحراریة، یمكن الاستنتاج أنه عند خلط غاز الھیدروجین مع غاز النيتروجين بنسبة (3:1) عند درجة حرارة (450 Co) وتحت ضغط (10 atm) فإن الضغط الجزئي للأمونيا يصل إلى (0.204 atm) وأن كمية الحرارة الناتجة عن هذا التفاعل تساوي (13.37 Kcal).
– لكن علم الدینامیكا الحراریة بمفرده لا یبین – مع الأسف – الوقت المطلوب لحدوث التفاعل الكيميائي. فمثلاً، یتنبأ علم الدینامیكا الحراریة بأن أكسدة ألماس (بلورات نقیة من الكربون) تحت ظروف عادیة من الممكن أن تحدث، أي أن التفاعل تلقائي. وبمعنى آخر یتنبأ علم الدینامیكا الحراریة بأن التفاعل التالي یحدث عند درجة حرارة الغرفة:
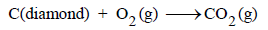
ولكننا نعلم جیداً بأن ھذا التفاعل لا یحدث بسرعة من الممكن ملاحظتھا تحت الظروف العادیة، أي أن ھذا التفاعل یستغرق وقتاً طویلاً جداً لكي یحدث.
– ھكذا یمكن القول بأن الفائدة المرجوة من دراسة قوانین الدینامیكا الحراریة الكیمیائیة، ھي أنھا تمكننا من القول بإمكانیة حدوث تفاعل كیمیائي معین أو عدم حدوثه.
تعريف التفاعل التلقائي
– التفاعل الذي یحدث من ذات نفسه في الظروف العادیة یعرف بالتفاعل التلقائي. ویمكن الإستفادة من الدینامیكا الحراریة في تحدید نوعیة التفاعل التلقائي، وكذلك موضع الإتزان في التفاعل الكیمیائي.
– وفي الحقیقة فإن علم الدینامیكا الحراریة لا یعطینا أیة معلومات كذلك عن میكانیكیة التفاعلات التلقائیة، وتجیب عن مثل ھذه التساؤلات دراسة حركیة التفاعلات (الحركیة الكیمیائیة)، فھناك بعض التغیرات التلقائیة التي تحدث ببطء شدید، فنجد أن الصورة التأصلیة الثابتة لعنصر الكربون عند الظروف العادیة ھي الجرافیت ولیس الألماس، والتحول من الألماس الى الجرافیت ھي عملیة تلقائیة من الوجھة الدینامیكیة الحراریة، وھذا التحول من البطء بمكان بحیث لا یمكن أن یلاحظ عند درجات الحرارة والضغوط العادیة ویحتاج الى ملایین السنین.
قائمة لأهم موضوعات الديناميكا الحرارية
فيما يلي أشهر موضوعات علم الديناميكا الحرارية Thermodynamic التي تم شرحها على موقع تعرف على علم الكيمياء
(أضغط على الموضوع الذي تريد قرأته)