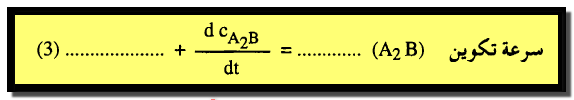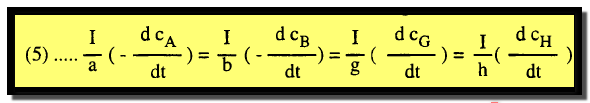سرعة التفاعل الكيميائي Rate of reaction والعوامل المؤثرة
في هذا الموضوع سيتم مناقشة تعريف سرعة التفاعل الكيميائي Rate of reaction والقوانين الخاص بها طرق قياسها والعوامل المؤثرة عليها بالتفصيل.
محتويات الموضوع
تعريف سرعة التفاعل الكيميائي Rate of reaction
– يعبر عن سرعة أي تفاعل كيميائي بمعلومية تركيز أحد المواد المتفاعلة والناتجة من التفاعل العام.
– وتعرف سرعة التفاعل بأنها المعدل الزمني للتغير في تركيز المواد المتفاعلة أو الناتجة. ففي التفاعل كما يلي:
2A + B → A2B
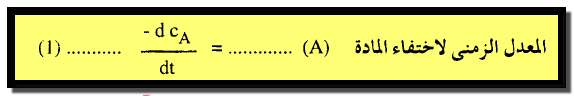
(1) يعبر عن سرعة التفاعل بالمعدل الزمني لاختفاء المادة A كما يلي:
حيث cA تركيز المادة (A) في زمن قدرة (t) وتعني الإشارة السالبة أن تركيز المادة (A) يتناقص مع الزمن.
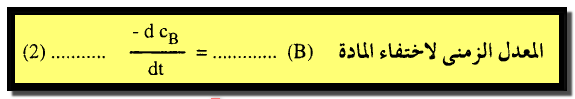
(2) يمكن التعبير عن السرعة أيضاً باختفاء المادة B كما يلي:
(3) كما يمكن التعبير عن السرعة بمعلومية تكوين الناتج A2B كما يلي:
– حيث تعني الإشارة الموجبة أن تركيز A2B يزيد مع الزمن وتستعمل هذه المشتقات لأن سرعة التفاعلات غالباً ما تتغير مع الزمن واستعمال تركيز المادة بدلاً من كميتها في تعريف السرعة يجعلها من الخصائص التي لا تتأثر بحجم النظام (Intensive property)
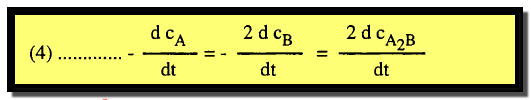
– يتضح من المثال السابق أن سرعات التفاعل المعبر عنها بالمعادلات 1, 2 ,3 ليست متساوية لأن سرعة اختفاء المادة A هي ضعف سرعة اختفاء المادة B وكذلك ضعف سرعة تكوين الناتج A2B.
– ولهذا يمكن التعبير عن سرعة هذا التفاعل بواسطة احد المشتقات المتكافئة الآتية كما يلي:
– ولهذا السبب فإنه من المهم أن تحدد المادة التي تؤخذ في الاعتبار عند التعبير عن السرعة التي قد تختلف من مادة إلى أخرى في نفس التفاعل. وفي الحالة العامة يمكن كتابة المعادلة العامة التالية كما يلي:
aA + bB → gG + hH
ومن السهل أن نستنتج:
ملاحظات هامة
– يستحسن استعمال وحدات التركيز المكافئ بدلاً من التركيز الجزيجرامي فى التعبير عن السرعة.
– فإذا كانت X هي عدد المكافئات في اللتر التي تتفاعل في الزمن فإن dx/dt هى التعبير الأنسب.
– بجانب التعبير فى التركيز فإن هناك متغيرات أخرى يمكن استعمالها في التعبير عن السرعة مثل الضغط في حالة التفاعلات الغازية والدوران الضوئي في حالة التفاعلات التي تتضمن مواداً نشطة ضوئياً.
– وتعتمد هذه المتغيرات دائماً على تركيز المواد المتفاعلة اعتماداً خطياً في العادة ولهذا يمكن أن تعامل كأنها مكافئة للتركيز.
تفسير سرعة التفاعل باستخدام العلاقات البيانية
– يمكن تفهم معنى سرعة التفاعل بوضوح أكثر إذا درست بيانياً.
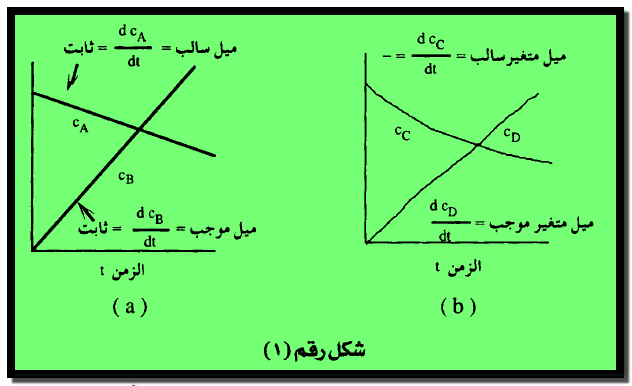
– نفرض أن العلاقة بين تركيز المواد المتفاعلة والناتجة مع الزمن هي علاقة خطية بالنسبة لتفاعل مثل A → B كما هو مبين بالشكل رقم (1)
– ويمكن التعبير عن سرعة التفاعل بالمعدل الزمني للتغير في تركيز المادة المتفاعلة أو الناتجة ( وتساوي السرعتين – dcA/dt و + dcB/dt) يميل كل من الخطين A و B على التوالي.
– وبما أن العلاقة خطية فإن الميل يكون ثابتاً ولهذا فإن سرعة التفاعل لا تعتمد على الزمن وحيث أن السرعات ثابتة لهذا التفاعل فإنها لا تعتمد أيضاً على تركيز المواد المتفاعلة أو الناتجة بالرغم من تغيرهما أثناء التفاعل وكما سنري فيما بعد يعتبر سرعة التفاعل من التفاعلات ذات الرتبة الصفرية.
– وإذا اعتبرنا تفاعلاً آخر C → D لا تكون فيه العلاقة بين التركيز والزمن علاقة خطية بل في صورة منحنى كما هو مبين في شكل (b1)
– ويلاحظ أن ميل المنحنى يتغير باستمرار مع الزمن وبما أن الميل يساوي السرعة فإن الأخيرة تتغير أيضاً مع الزمن ومع تركيز المواد المتفاعلة والناتجة وكما سنرى فيما بعد أن هذه التفاعلات ليست من الرتبة الصفرية.
العوامل المؤثرة على سرعة التفاعل الكيميائي
Factors affecting reaction rate
– تعتمد سرعة التفاعلات الكيميائية على عدة عوامل أهمها كما يلي:
(1) طبيعة المواد المتفاعلة Nature of reactants
– تتغير السرعة من تفاعل إلى آخر تبعاً كما يلي:
- للحالة الطبيعية للمواد المتفاعلة ( غاز – سائل – صلب)
- ونوعها (أيون – جزئ متعادل – شق حر)
- وأيضاً تبعاً لتركيبها الكيميائي.
(2) درجة الحرارة Temperature
– تزداد سرعة التفاعل في معظم الأحيان بزيادة درجة الحرارة.
– قد وجد أنه في حالات كثيرة تتضاعف سرعة التفاعل مرتين أو ثلاث مرات لكل زيادة في درجة الحرارة قدرها 10 Co
(3) التركيز Concentration
– في معظم الحالات تكون سرعة التفاعل الكيميائي دالة لتركيز بعض أو كل المواد المشتركة في التفاعل (مواد متفاعلة وناتجة) ولكن في العادة المواد المتفاعلة فقط.
– الزيادة في تركيز المواد المتفاعلة عموماً تزيد من سرعة التفاعل.
– يجب أن نضع في الاعتبار أن سرعة أي تفاعل لا تظل ثابتة طوال سير التفاعل ولكنها تكون أعلى ما يمكن فى البداية ثم تقل تدريجياً مع الزمن كلما استهلكت المواد المتفاعلة.
– من الوجهة النظرية تحتاج سرعة التفاعل إلى وقت لا نهائي لكي تصل إلى الصفر.
– عملياً فإن السرعة تصبح أقل ما يمكن بعد فترة عندها يصبح من المستحيل قياس سرعة التفاعل.
(4) الضغط والحجم Volume and Pressure
– عند دراسة التفاعلات الغازية نجد أنه من الممكن تثبيت حجم النظام أو ضغطه.
– أبسط طريقة هي تثبيت النظام الغازي في الوعاء الحاوي له ثم ندرس الزيادة في الضغط مع الزمن وهي غالباُ ما تكون دالة مباشرة للتغير في التركيز مع الزمن.
– في التفاعلات التي تتم في الأنظمة السائلة والصلبة يسهل التحكم في الضغط.
(5) العوامل المساعدة Catalysts
– يتأثر عدد كبير من التفاعلات بوجود كميات صغيرة جداً من مواد لها القدرة على إسراع أو إبطاء سرعة هذه التفاعلات وتسمى هذه المواد بالعوامل المساعدة
– تعرف التفاعلات التي تتأثر بها بالتفاعلات المحفزة Catalyzed reactions ويطلق على اسم الحفز Catalysis.
– يعرف العامل الحفاز بأنه المادة التي تستعمل أثناء تفاعل كيميائي ولكنها تسترد في نهاية التفاعل دون أن تتأثر كيميائياً.
– أي أن العامل المساعد يتدخل في التفاعل في أحد مراحله المتوسطة فقط ولكنه يسترد في النهاية كما كان.
– إذا سبب العامل المساعد زيادة في سرعة التفاعل فأنه يسمى عامل مساعد موجب وإذا سبب نقصاً في السرعة فيعرف بالعامل المساعد السالب
(6) وسط التفاعل
– يكون للوسط الذي يتم فيه التفاعل في حالة التفاعلات السائلة تأثيراً كبيراً على السرعة.
– قد وجد أن تغيير المذيب يمكن أن يغير من سرعة التفاعل السائل إلى عدة أضعافها.
– من الأمثلة المشهورة لهذه الحالة تفاعل يوديد الإيثيل مع ثلاثي ميثيل أمين لتكوين ملح أمونيومي رباعي ، حيث وجد أن سرعة التفاعل تزداد إلى 1000 ضعف إذا تغير المذيب الهكسان الحلقي إلى النيتروبنزين عند نفس الظروف.
(7) مساحة السطح Surface area
– يطلق اصطلاح التفاعلات المتجانسة على كل التفاعلات التي تتم في حالة طبيعية واحدة (غازية أو سائلة) وهي عموماً حالة معظم التفاعلات البسيطة التي تتم فى المحاليل.
– أما التفاعلات التي تتم فقط على سطح الانفصال بين حالتين مختلفتين فتسمى بالتفاعلات غير المتجانسة.
قانون سرعة التفاعل Rate of reaction Expression
– تسمى العلاقة الأساسية بين السرعة والتركيز بقانون السرعة أو بالمعادلة الحركية. وعموماً لا يمكن التنبؤ بقانون السرعة لأي تفاعل بمجرد معرفة المعادلة الكيميائية الموزونة.
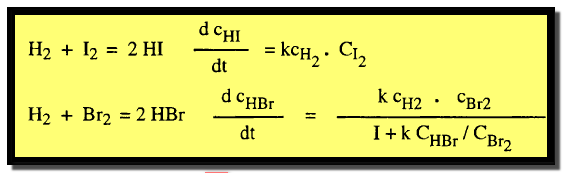
– فمثلاً بالرغم من أن التفاعل بين الهيدروجين وكل من اليود أو البروم يتبع نفس المعادلات الكيميائية إلا أن قانون السرعة يختلف اختلافاً تاماً في الحالتين كما يلي:
– يفسر هذا الاختلاف في معادلة السرعة بالاختلاف في ميكانيكية كل من التفاعلين.
– ففي حالة الهيدروجين واليود يتم التفاعل عن طريق صدمات ثنائية بين جزئ واحد من كل منهما.
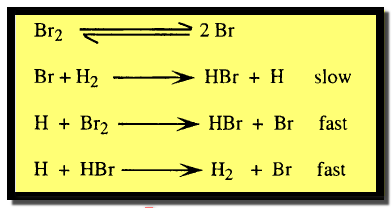
– أما في حالة الهيدروجين والبروم فإن التفاعل يتم بصورة معقدة. تتضمن أولاً تفكك جزئيات البروم إلى ذرات يتبعها تفاعل بين هذه الذرات وبين الجزئيات كما يلي:
– يتضح من الأمثلة السابقة أنه لا يمكن التنبؤ بميكانيكية التفاعل اعتماداً على التفاعل الكلي فقط.
الطرق العملية لقياس سرعة التفاعل
– يمكن تعيين سرعة التفاعل بدراسة التركيز كدالة للزمن. ويتم هذا عند درجة حرارة ثابتة.
– حيث يحضر مخلوط التفاعل بتركيزات ابتدائية معينة. ويوضع في حمام ذي درجة حرارة ثابتة.
– تقاس الزيادة في تركيز المواد الناتجة أو النقص في تركيز المواد المتفاعلة مع الزمن باستعمال طريقة مناسبة.
– من هذه النتائج يمكن استنتاج السلوك الحركي للتفاعل وكذلك قانون السرعة.
– يمكن دراسة اعتماد السرعة على درجة الحرارة بإعادة العملية عدة مرات عند درجات حرارة مختلفة.
– هناك طريقتان لتعيين تركيز مادة متفاعلة أو ناتجة وهما الطريقة الكيميائية والطريقة الطبيعية كما يلي:
الطريقة الكيميائية
– تتضمن هذه الطريقة التعيين المباشر لتركيز أحد المواد المتفاعلة أو الناتجة باستعمال التحليل الحجمى أو الوزني وتفضل الأولى لسرعتها فتؤخذ عينات من التفاعل عند فترات زمنية معينة ثم يوقف التفاعل في هذه العينات وتحلل لتعيين التركيز.
– إيقاف التفاعل أو إبطاء سرعته إلى أدنى حد ممكن في العينات المأخوذة عامل هام جداً في دراسة السرعة.
– يتم هذا بواسطة عمل تغير مفاجئ مثل خفض درجة الحرارة بتبريد العينة تبريداً سريعاً أو إزالة العامل المساعد أو إضافة مانع لحدوث التفاعل أو انتزاع مادة متفاعلة.
– فإذا كانت المادة المراد تعيين تركيزها قاعدية يمكن معايرتها بواسطة حمض قياسي وإذا كانت المادة كلوريد متأين يمكن معاينتها بمحلول نترات فضة قياسي وهكذا.
– من مزايا الطريقة الكيميائية للتحليل أنها تعطي القيمة المطلقة للتركيز. ولكنها ليست أحسن الطرق للحصول على نتائج دقيقة لأنها تخلط بمخلوط التفاعل. وكذلك لأنها تستغرق وقتاً معيناً في عملية إيقاف التفاعل في العينة.
الطريقة الطبيعية
– تعتبر هذة الطرق كلما أمكن تطبيقها اكثر ملائمة من الطريقة الكيميائية لأنها تتجنب عيوب الطريقة الكيميائية.
– في الطريقة الطبيعية يدرس التفاعل باستعمال خاصية طبيعية معينة تتغير مع الزمن ويمكن بواسطتها حساب درجة التركيز.
– مثلاً في التفاعلات الغازية المصحوبة بتغير في الحجم فإن أنسب خاصية يمكن دراستها هي التغير في الضغط عند ثبوت الحجم أو التغير في الحجم عند ثبوت الضغط . وتستعمل الطريقة الأخيرة أحياناً في بعض الأنظمة السائلة المصحوبة بزيادة في الحجم وأيضاً إذا كانت المواد المتفاعلة أو الناتجة لها القدرة على أن تدير مستوى الضوء المستقطب.
– أي إذا كانت المواد نشطة ضوئياً فإن التغير فى التركيز مع الزمن يمكن أن يدرس بقياس مدى التغير في درجة النشاط الضوئي للمخلوط المتفاعل.
– من الطرق الطبيعية الأخرى التي يمكن استعمالها التوصيل الكهربائي، معامل الانكسار، التصاعد الغازي، التحليل الطبقي، التحليل الوزني، اللزوجة، التشتت الضوئي، الرسم القطبي، الحساسية المغناطيسية، الطيف الكتلي، ثابت العزل.
– تمتاز الطريقة الطبيعية للتحليل بأنها سريعة بحيث يمكن بواسطتها تسجيل عدة قراءات عملية في وقت محدود.
– تؤخذ هذه القياسات عادة في نفس الوعاء الحاوي للتفاعل بدون أخذ عينات. وهكذا يمكن تجنب الخطأ في قياس هذه العينات.
– من عيوب هذه الطريقة أنها لا تعطي قيماً مباشرة للتركيز المطلق. كما أن الأخطاء الناتجة من التفاعلات الجانبية المصاحبة للتفاعل الأساسي تظهر بوضوح في هذه الطريقة.
إقرأ هذة الموضوعات المهمة كما يلي: (أضغط على الموضوع الذي تريده)
(1) سرعة التفاعل الكيميائي وطرق قياسها والعوامل المؤثرة عليها
(2) أثر درجة الحرارة على سرعة التفاعل الكيميائي
(3) أثر طبيعة المواد المتفاعلة على سرعة التفاعل الكيميائي