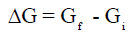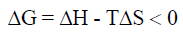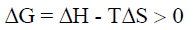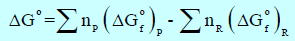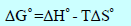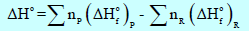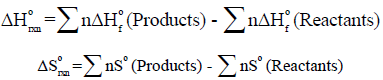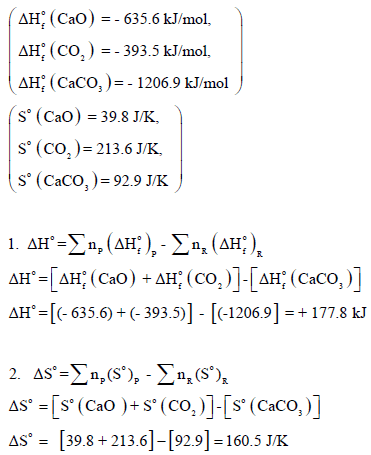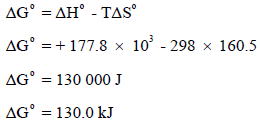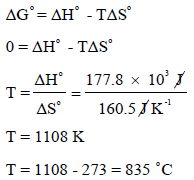طاقة جبس الحرة Gibbs Free Energy

طاقة جبس الحرة Gibbs Free Energy
– طاقة جبس الحرة هي خاصية ثيرموديناميكية تجمع بين أنتروبي وإنثالبي النظام من أجل تحديد ما أذا كان تفاعل ما تلقائي .
– يرمز لطاقة جبس الحرة بالرمز (G) وتعرف من العلاقة:
G = H – TS
وكلها كميات تخص النظام فقط.
– ووحدات طاقة جبس الحرة (G) هي وحدات الطاقة أي الجول
– يمكن كتابة التغير في طاقة جبس الحرة (التغير في الطاقة الحرة):
– وبما أن (S,H) تابعان للحالة فإن (G) تابع للحالة أيضاً، أي أنها تعتمد فقط على الحالة الابتدائية والنهائية للنظام أي أن:
– لكي يكون تفاعل ما تلقائياً يجب أن تكون قيمة (Gf) أصغر من قيمة (Gi) أى أن قيمة (ΔG) سالبة.
التنبؤ بتلقائیة التفاعل
بالاعتماد على المعادلة التالية يمكنك التنبؤ بتلقائية التفاعل من عدمه:
(1) إذا كانت قيمة كل من (ΔH = – ) ، (ΔS = + )
إذا كان التفاعل مصحوباً بانخفاض في الإنثالبي ΔH أي (ΔH = – ) ، وزيادة في الأنتروبي ΔS أي (ΔS = + ) فأن:
وبالتالي فإن قيمة (ΔG) سالبة. وهذا يعنى أن التفاعل يحدث تلقائياً عند جميع درجات الحرارة.
(2) إذا كانت قيمة كل من (ΔH = + ) ، (ΔS = – )
إذا كان التفاعل مصحوباً بزيادة في الإنثالبي ΔH أي(ΔH = + ) ، وانخفاض في الأنتروبي ΔS أي (ΔS = – )
فأن:
وبالتالي فإن قيمة (ΔG) موجبة. وهذا يعنى أن التفاعل سيكون غير تلقائي عند جميع درجات الحرارة.
(3) إذا كانت قيمة كل من (ΔH = + ) ، (ΔS = + )
فإن قیمة درجة الحرارة تلعب دوراً في تحديد ما إذا كان التفاعل تلقائياً أم لا:
(أ) فإذا كانت درجة حرارة (T) عالية بشكل يجعل الحد (TΔS) أكبر من الحد ( (ΔH:
أي أن قيمة (ΔG = – ) وبالتالي فإن التفاعل يحدث تلقائياً.
(ب) فإذا كانت درجة حرارة (T) منخفضة بشكل يجعل الحد (TΔS) أقل من الحد ( (ΔH:
أي أن قيمة (ΔG = + ) وبالتالي فإن التفاعل غير تلقائي.
(4) إذا كانت قيمة كل من (ΔH = – ) ، (ΔS = – )
فإن قیمة درجة الحرارة تلعب دوراً في تحديد ما إذا كان التفاعل تلقائياً أم لا:
(أ) فإذا كانت درجة حرارة (T) منخفضة بشكل يجعل الحد (TΔS) أكبر من الحد ( (ΔH:
أي أن قيمة (ΔG = – ) وبالتالي فإن التفاعل يحدث تلقائياً.
(ب) فإذا كانت درجة حرارة (T) مرتفعة بشكل يجعل الحد (TΔS) أقل من الحد ( (ΔH:
أي أن قيمة (ΔG = + ) وبالتالي فإن التفاعل غير تلقائي.
(5) إذا كانت 0 = ΔG
فإن هذا يعنى أن التفاعل ليس لديه القابلية أن يحدث سواء في الإتجاة المباشر أو الإتجاة المعاكس أن التفاعل في حالة توازن.
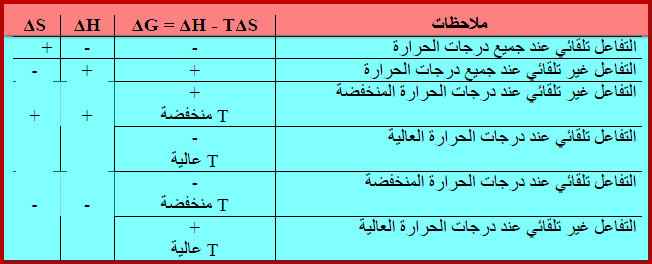
– الجدول التالي يوضح ملخص لتأثير درجة حرارة التفاعل على تلقائيته:
– حتى تكون عملية ما تلقائية بغض النظر عن درجة حرارتها يجب أن تكون: (ΔH < 0, ΔS > 0).
التغير في الطاقة الحرة القياسية Standard Free Energy Change
– یمكن حساب التغیر في الطاقة الحرة القیاسیة من العلاقة التالیة:
– ومنه فإن التغیر في الطاقة الحرة القیاسیة لتفاعل ما یساوي مجموع قیم طاقات التكوین الحرة القیاسیة للمواد الناتجة مطروحاً منه مجموع قیم طاقات التكوین الحرة القیاسیة للمواد المتفاعلة.
تعريف طاقة التكوین الحرة القیاسیة ΔGf o
– طاقة التكوین الحرة القیاسیة ΔGf o لمركب ما: عبارة عن التغیر في الطاقة الحرة المصاحب لتكون مول واحد من مركب ما من عناصره الأولیة وھي في حالتھا القیاسیة. وتكون طاقة التكوین الحرة القیاسیة لأي عنصر في حالته القیاسیة تساوي صفراً.
– يمكن حساب ΔGo من العلاقة:
– ويحسب ΔHo من قيم حرارة التكوين القياسية ΔHf o من العلاقة:
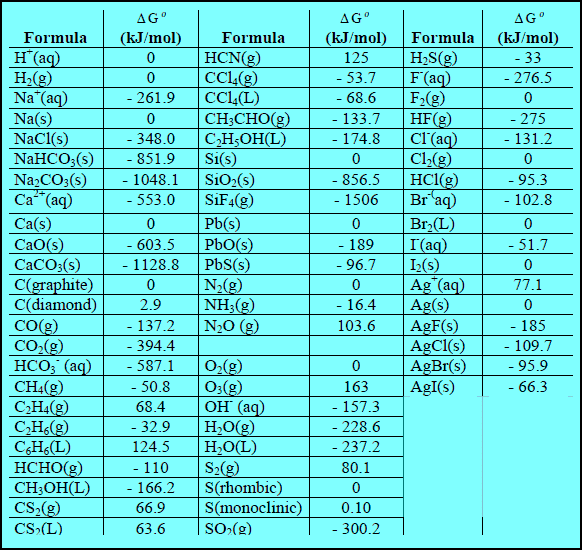
– الجدول التالي يوضح قيم طاقة التكوين الحرة القياسية عند (25 Co)
تأثير درجة الحرارة في التفاعلات الكيميائية وفقًا للمعادلة ΔG = ΔH – TΔS
– سنناقش تحضیر أكسید الكالسیوم من تحلل كربونات الكالسیوم عند درجات الحرارة العالیة:
– تتحل لكربونات الكالسیوم في تفاعل انعكاسي حیث یتحد أكسید الكالسیوم CaO بسھولة مع غاز ثاني أكسید الكربون CO2 لیكون كربونات الكالسیوم. إن ضغط CO2 مع CaO و CaCO3 یزید بزیادة درجة الحرارة. وبالتالي فلإنتاج كمیات أكبر من أكسید الكالسیوم یسحب غاز CO2 دائماً من وسط التفاعل الأمر الذي یجعل الاتزان ینزاح من الیسار (المتفاعلات) إلى الیمین (النواتج).
– وأھم معلومة ھنا تكمن في معرفة درجة لحرارة التي تتحلل فیھا أكبر كمية من كربونات الكالسیوم، أو بمعنى آخر ما ھي درجة الحرارة التي یكون فیھا التفاعل تلقائیاً؟.
– لتقدیر درجة الحرارة ھذه فإننا نحسب ΔHο , ΔSο باستخدام المعادلتين:
عند درجة حرارة 25 Co
وبالنسبة لتفاعل یحدث عند الحالة القیاسیة فإن:
بما أن قيمة ΔGο كبيرة وموجبة فيمكن استنتاج أن هذا التفاعل غير مرغوب فيه عند درجة حرارة (25 Co) ولكي نجعل ΔGο سالبة يجب علينا أولاً أن نوجد درجة الحرارة التي تعادل فيها قيمة ΔGο الصفر.
وهذا يعني أنه عند أي درجة حرارة أعلى من 849 Co فإن قيمة ΔGο تصبح سالبة، الأمر الذي يعنى أن تحلل الكربونات سوف يكون تلقائياً. فمثلاً عند درجة الحرارة (855 Co = 1128 K) نجد أن:
توجد ملاحظتان مھمتان یجب الإشارة إلیھما في مثل ھذه الحسابات:
أولاً/ لقد استخدمنا قيم ΔHο , ΔSο عند درجة الحرارة (25 Co) لحسابات التغيرات التي تحدث عند 855 Co، وحيث أن كلاً من ΔHο , ΔSο يتغيران مع تغير درجة الحرارة فإن هذا التعامل لا يعطي قيماً صحيحة للتغير في ال طاقة الحرة ولكنه يمثل خطوة عظيمة في سبيل تقدير ΔGο
ثانياً/ يجب أن لا تعتمد على أنه لا يحدث شئ تحت درجة الحرارة 835 Co وأن كربونات الكالسيوم فجأة تتحلل عند فهاتان العمليتان الاتحاديتان لا تحدثان أبداً.
– إن حقیقة أن قیمة تكون موجبة ΔGο عند درجة حرارة أقل بقلیل من 835 Co لا تعني أن CO2 لا ينتج، ولكنها تتحدث عن أن ضغط ثاني أكسيد الكربون المنتج عند درجة الحرارة هذه يكون أقل من (1 atm) وهي الحالة القياسية له.
– الشكل التالي يوضح ضغط CO2 عند الاتزان الناتج من تحلل CaCO3 بالتسخين.
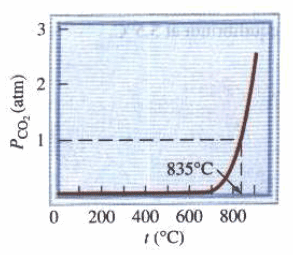
الشكل يظهر أن ضغطCO2 يزيد أولاً ببطء شديد مع زيادة درجة الحرارة حتى يصبح من الممكن قياسه فوق درجة الحرارة 700 Co . أن أهمية درجة الحرارة 835 Co تكمن في أنها درجة الحرارة التي يصل فيها ضغط CO2 إلى ضغط جوي (1 atm).
انفوجراف توضيحي
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية