الكيمياء الفيزيائية
ما هو الأنتروبي ?What is ENTROPY

تعريف الأنتروبي Definition of Entropy
(1) الأنتروبي Entropy والذي يرمز له بالرمز (S) هو: مقياس مباشر لخاصية عدم الانتظام (درجة الفوضى – العشوائیة) بین الجسیمات (أیونات، ذرات أو جزیئات) المكونة للنظام.
(2) الأنتروبي ھو مقیاس للعشوائیة (مقیاس لعدم الإنتظام).
(3) الأنتروبي (S): خاصیة ثیرمودینامیكیة تصف الى أي مدى تصل درجة الفوضى وعدم انتظام جسیمات النظام، وتشتت الطاقة المصاحبة لھذه الجسیمات.
وكلما كان الانتظام قلیلاً في النظام (العشوائیة أكبر) كلما كانت قیمة الأنتروبي كبیرة،
وكلما كان النظام أكثر انتظاماً (أقل عشوائیة) كلما كانت قیمة الأنتروبي صغیرة.
وكلما كان الانتظام قلیلاً في النظام (العشوائیة أكبر) كلما كانت قیمة الأنتروبي كبیرة،
وكلما كان النظام أكثر انتظاماً (أقل عشوائیة) كلما كانت قیمة الأنتروبي صغیرة.
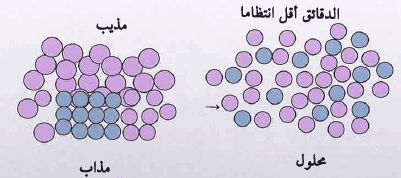
** الشكل التالي يوضح بأن دقائق المادة تصبح أقل انتظاماً في المحلول وهذا يعني حصول زيادة في الانتروبي عند إذابة المذاب في المذيب
أمثلة توضيحية على الأنتروبي Examples on Entropy
مثال (1):
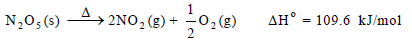
فجزيئات الغازين (NO2) و (O2) أقل انتظاماً من بلورات (N2O5) الصلبة.
مثال (2): یتفكك كلورید الأمونیوم في الماء تلقائیاً:
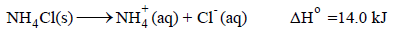
وھذه الذائبیة بالرغم من أنه یصاحبھا زیادة في الإنثالبي (ΔH = + 14 kJ) إلا أن الذوبان تلقائي، ویمكن تفسیر ذلك بأن أیونات الكلور والأمونیوم في المحلول أقل انتظاماً منها في بلورة كلورید الأمونیوم.
مثال (3):
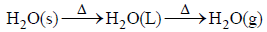
جزیئات الماء في الحالة البخاریة أقل انتظاماً من جزیئات الماء في الحالة السائلة، وجزیئات الماء المتجمدة في الحالة الصلبة، وبشكل عام فإن الحالة الغازیة أقل انتظاماً من الحالة السائلة، والحالة السائلة أقل انتظاماً من الحالة الصلبة. (كما بالشكل)
يوضح الشكل التالي زیادة الأنتروبي ( خاصیة عدم الإنتظام) عند التحول من الحالة الصلبة الى الحالة السائلة ثم الى الحالة الغازية
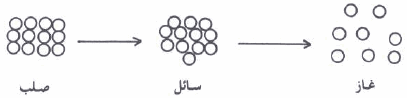
الأنتروبي لحالات المادة الثلاثة
– یلاحظ من الجدول التالي:
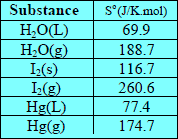
أن قیم الأنتروبي في الحالة الغازیة لجمیع ھذه المواد أكبر منھا للحالة السائلة أو الحالة الصلبة:
S(s) < S(L) < S(g)
S(s): أنتروبي المادة الصلبة
S(L): أنتروبي المادة السائلة
S(g): أنتروبي المادة الغازية
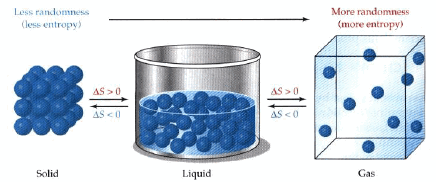
– وبالتالي فإن الاتجاه المفضل للتغیر ھو الإتجاه الذي تزداد فیه درجة الفوضى أو عدم الإنتظام.
– الشكل التالي یوضح بعض العمليات التي أدت لزيادة الأنتروبي حيث أنه في كل حالة تتغیر المنظومة من حالة أكثر تنظیماً الى أخرى أقل تنظیماً.
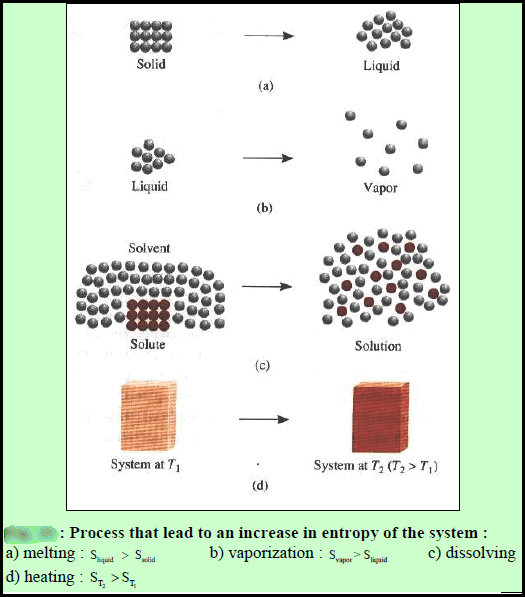
ومن الواضح أن كلاً عمليتى الإنصهار والتبخير تقودلن لتغير في الأنتروبي أكبر من الصفر (ΔS > 0) عندما تذوب المادة الصلبة الأیونیة في الماء فإن البناء البلوري عالي التنظیم للمادة الصلبة والبنیة المنتظمة للماء یتحطمان. كنتیجة لذلك فإن المحلول یمتلك عدم تنظیم أكبر من المذاب النقي أو المذیب النقي.
كذلك فإن التسخین یزید من أنتروبي المنظومة حیث تزید طاقة الحركات الجزیئیة المختلفة بزیادة درجة الحرارة. وھذا یعني أن الزیادة في التبعثرعلى المستوى الجزیئي تزید من الأنتروبي.
الأنتروبي دالة للحالة Entropy is state function
– الأنتروبي دالة للحالة (أي یعتمد على الحالة الإبتدائیة والحالة النھائیة ولا یعتمد على المسار الذي يسلكه النظام).
– وبما أن الأنتروبي دالة حالة إذاً فأنه يقاس التغير فيه (ΔS) لأي عملیة یتم فیھا تغیر النظام من حالته الإبتدائیة الى حالته النھائیة.
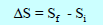
Si: أنتروبي النظام في الحالة الإبتدائیة
Sf: أنتروبي النظام في الحالة النھائیة
فائدة قیمة الأنتروبي Importance of Entropy value
– یستفید الكیمیائیون من قيمة الأنتروبي في معرفة ما إذا كان تفاعل كیمیائي یمكن أن یحدث تلقائیاً أم لا، عند ظروف معینة من الضغط ودرجة الحرارة.
– جمیع التفاعلات الكیمیائیة والتحولات الفیزیائیة السابقة یرافقھا زیادة في عدم الإنتظام (زیادة في العشوائیة أي زیادة في قیمة الأنتروبي).
– إذا افترضنا أن كمية من الحرارة مقدارها (q) تمتص من قبل نظام مكون من قطعة ثلج (حیث یلاحظ أن التركیب البلوري للثلج والذي تحتل فیه جزیئات الماء مواقع منتظمة في الشبكة البلوریة یتحطم تدریجیاً، وتصبح جزیئات الماء أقل انتظاماً نتیجة لذوبانھا أي تزداد درجة الفوضى أو العشوائیة في النظام).
وإذا كانت كمیة الحرارة قد امتصت من قبل النظام عند درجة الحرارة المطلقة (T) فإن مقدار التغیر في أنتروبي النظام یعطى حسب المعادلة:
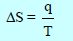
بشرط أن تتم عملیة امتصاص الحرارة ببطء لتحاشي أي فرق في الضغط أو درجة الحرارة بین النظام ومحیطه.
وحدات قياس الأنتروبي Units of Entropy
من المعادلة السابقة:
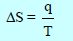
فأن الأنتروبي يقاس بوحدة (J/K) ولمول واحد من المادة بوحدات (J/K mol).
ملاحظات هامة على الأنتروبي
(1)ھل جمیع العملیات التلقائیة مصحوبة بزیادة في الأنتروبي؟
لا، لیست جمیع العملیات مصحوبة بزیادة في الأنتروبي، ومثال ذلك:
(أ) عملية التمثيل الضوئي في النبات Photosynthesis والتى يتم فيها تحويل CO2 ، H2O والمواد الأخرى في وجود الطاقة الشمسیة الى نظام في غایة الإنتظام.
(ب) یتم تحویل الأكسجین والماء والأطعمة المختلفة الى نظام في غایة الإنتظام والتعقید.
(2) ھل معرفة تغیر الأنتروبي (موجباً أو سالباً) لنظام ما یتیح التنبؤ بحتمیة تلقائیة ھذا التغیر؟
لا، لا یتیح الأنتروبي لنظام ما بحتمیة تلقائیة التفاعل.
وبالتالي مادام الإنخفاض في الطاقة، وتغیر الأنتروبي لا یحددان بشكل مؤكد تلقائیة عملیة ما فإنه لا بد من خاصیة ثیرمودینامیكیة أخرى تجمع بین التغیر في الإنثالبي والتغیر في الأنتروبي وھذه الخاصیة هي التغیر في الطاقة الحرة ویرمز لھا بالرمز .(ΔG)\
المراجع:
المراجع:
– أسس الكيمياء العامة والفيزيائية / الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية
– مبادئ الثرموديناميك / أ.د. فلاح حسن حسين – كلية العلوم جامعة بابل / الطبعة الثانية 2012







مشكور على هذه المعلومات القيمة