الكيمياء الفيزيائية
خواص السوائل وخواص المواد الصلبة liquids and solids properties
(1) الحالة السائلة The Liquid State
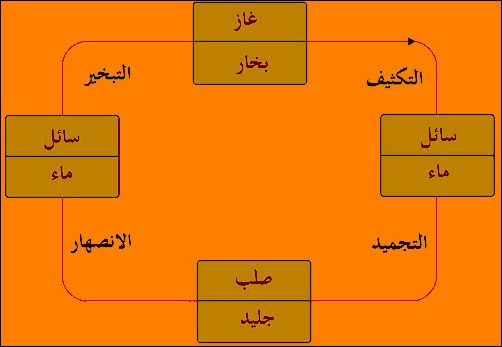
–الحالة السائلة ھي الحالة الوسط بین الحالتین : الصلبة والغازیة حیث یمكن الحصول علیھا بانصھار الحالة الصلبة أو بتكثیف الحالة الغازیة.
– تتكون الحالة السائلة من جزیئات ذات حركة مستمرة وعشوائیة وبین ھذه الجزیئات قوى تجاذب داخلیة، كما أن معدل طاقة حركتھا یتناسب طردیاً مع درجة الحرارة المطلقة لھذه السوائل .
(2) القياسات المهمة في الصفات الفيزيائية للسوائل
– القیاسات المھمة في الصفات الفیزیائیة للسوائل ھي:
الضغط البخاري ، التبخر، درجة الغلیان، التوتر السطحى ، اللزوجة ، الانكسار الضوئي ، النشاطیة الضوئیة، العزم الزاوي.
– معرفة الصفات الفیزیائیة ذو فائدة لكل من نقاط البحث العملیة والنظریة.
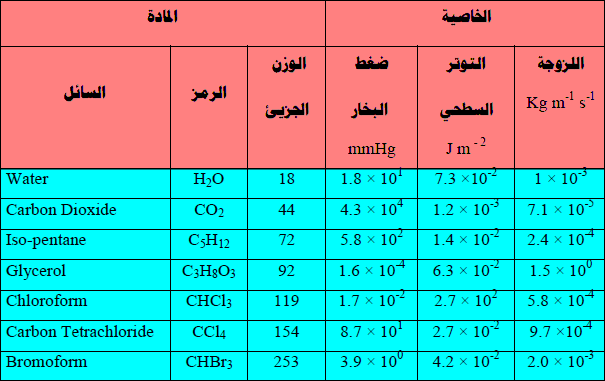
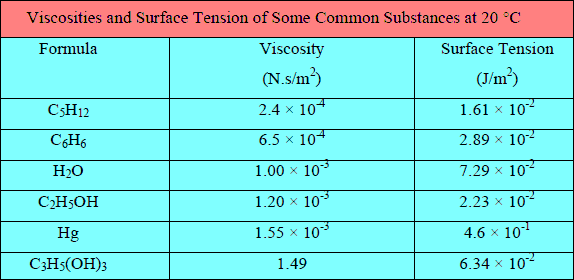
– الجدول التالي يوضح القیم العددیة لعدد من خواص لبعض السوائل عند 20 Co
(3) تقسيم الصفات الفيزيائية للسوائل إلى ثلاث مجموعات
(1) صفات إضافية Additive Properties
ھذه الصفات عبارة عن مجموعة من الصفات للمركب كلا عًلى حده في النظام ولا تتغیر مع تغیر حالة النظام، منھا: الكتلة، الوزن الجزیئي وھما صفات إضافة تامة.
(2) صفات أساسية Constitutive Properties
ھذه الصفات تعتمد أولاً على توزیع الذرات في الجزیئات، وتعتمد في مدى بسیط على طبیعة السائل وعدد الجزیئات، ومن ھذه الصفات: النشاط الضوئي، الإستقطاب.
(3) صفات مجمعة Colligative Properties
ھذه الصفات تعتمد على عدد الجزیئات ولا تعتمد على طبیعتھا. ومن ھذه الصفات الإنخفاض في الضغط البخاري، والصفات النسبیة مثل الإنخفاض في نقطة التجمد، الإرتفاع في نقطة الغلیان، والضغط التبادلي (الأسموزي).
(4) ما الفرق بین الحالة السائلة والحالة الغازیة؟
الفرق بین الحالتین ینحصر في المسافة الفاصلة بین الجزیئات والتي تمتاز بأنھا صغیرة جداً في حالة السوائل، وھذا
یعني أن قوى التجاذب بین الجزیئات في الحالة السائلة ستكون أعلى منھا مقارنة بالحالة الغازیة.
یعني أن قوى التجاذب بین الجزیئات في الحالة السائلة ستكون أعلى منھا مقارنة بالحالة الغازیة.
(5) خواص السوائل Liquids properties
فيما يلي أهم خواص السوائل:
(1) لا ینتشر السائل في الحیز الذي یحتویه كما ھو الحال في الغازات، بل لا يشغل منه إلا حجماً محدداً یتخذ السائل في شكله شكل ھذا الحیز.
(2) تشترك الحالة السائلة مع الحالة الغازیة للمادة في القابلیة على الإنسیاب.
وتوصف ھاتان الحالتان بالحالة المائعة للمادة Fluid state
(3) قوة التجاذب بین الجزیئات في السوائل أكبر بكثیر مما ھي علیه في الغازات وأقل مما ھي علیه في الحالة الصلبة.
(4) قابلیة السائل للإنضغاط مقارنة بقابلیة الغازات شبه معدوم ة لأن الحیز الفارغ بین جزیئات السائل صغیر جدا، وبالتالي فإن السوائل غیر قابلة للإنضغاط.
إن عدم قابلیة السوائل للانضغاط خاصية ھامة ومفیدة، فجمیع أنواع الآلات الھیدرولیكیة تعتمد علیھا في نقل قوى ضخمة تقوم برفع وتحریك أشیاء ثقیلة. كما تعتمد علیھا أنت بنفسك عندما تدوس على فرامل السیارة، فالقوة التي تمارسھا قدمك یتم تضخیمھا أولاً، ومن ثم نقلھا بواسطة زیت عبر أنابیب الفرامل، حیث تجبر لقم الفرملة بالإحتكاك بسطح وإیقاف السیارة. وإذا ما دخل الھواء في أناب ب الفرامل فإن القوة التي تمارسھا قدمك تضغط الھواء فقط، ولا تستطیع السیارة التوقف بسرعة كبیرة على الإطلاق (فتحدث كارثة لا تحمد عقباھا لا قدر الله).
(6) خواص المادة الصلبة Solids properties
تتمیز المادة الصلبة بخواص منھا:
(1)عدم تغیر شكلھا وحجمھا (تأخذ شكلاً وحجماً ثابتاً لا یتأثر بالضغط أو الحرارة).
ویرجع السبب في ذلك إلى أنه في الصلب تكون الوحدات التركیبیة (سواءً كانت ذرات أو أیونات أو جزیئات) مترابطة مع بعضھا البعض بقوى كبیرة منتظمة تماماً (قوى التجاذب فیما بین جسیمات المادة الصلبة عالیة)، ومثبتة في أماكن محددة، ولا یكون ترتیبھا الفراغي عشوائیاً كما ھو الحال في الغازات والسوائل، وتتذبذب الجسیمات بالنسبة لأماكنھا المحددة ولكنھا لا تترك المادة.
(2) درجة انصھارھا عالیة.
(3) كثافتھا عالیة.
(4) عدم قابلیتھا للإنضغاط أو الإنتشار.
(5) تأخذ شكلاً ھندسیاً یطلق علیه الشبكة البلوریة.
(7) أنواع المواد الصلبة Types of solid Materials
وتقسم المواد الصلبة إلى مواد صلبة بلوریة وأخرى غیر بلوریة.
(أ) المواد الصلبة البلورية Crystalline Solids
– تتمیز المواد الصلبة البلوریة بأن لھا : نقطة انصھار محددة – حرارة انصھار محددة – شبكة بلوریة محددة
– تكون الذرات، الأیونات أو الجزیئات في الصلب المتبلر مرتبة في نظام محدد، یتكرر على الدوام.
– قد تكون قوى الربط ناشئة عن :
– التجاذب بین الأیونات الموجبة والسالبة، كما في كلورید الصودیوم NaCl
– أو تكون نتیجة لوجود روابط كیمیائیة تتماسك فیھا الذرات بروابط تكافؤ في تركیبات متواصلة
كما في الماس.
كما في الماس.
– وقد تنشأ قوى الربط عن تجاذب الجزیئات كما في ثاني أكسید الكربون CO2 الصلب (الثلج الجاف).
(ب) المواد الصلبة غير البلورية
– تعرف المواد الصلبة التي لا تتوافر فیھا الشروط السابقة بالمواد الصلبة غیر البلوریة.
– ومن أمثلة المواد الصلبة غیر البلوریة : الزجاج – المطاط – الصمغ الجامد.
– قد أطلق تعبیر (أمورفي) على المادة التي لا یكون لھا شكل ھندسي طبیعي أو تركیب داخلي مرتب، ولا یكون لأسطحھا أوجه محددة، متكررة كما ھو الحال في المادة البلوریة.
– تكون جسیمات المادة الأمورفیة مرتبة ترتیباً عشوائیاً كما ھو الحال في السوائل. ولذلك فإنھا تعتبر سوائل في مدى من درجات الحرارة، بخلاف المواد البلوریة التي تنصھر عند درجة حرارة ثابتة.
ملاحظات هامة
– إذا ما اختلفت خواص البلورات (قوى الشد، المرونة، التوصیل الحراري، التوصیل الكھربي، معامل الانكسار، سرعة الذوبان) باختلاف الإتجاھات، فإن الجامد یعرف بأنه غیر منتظم وتتضح ھذه الظاھرة في جمیع البلورات ماعدا الأنظمة المكعبة أو المنتظمة.
– إذا تساوت خاصیة ما في جمیع الإتجاھات، تعرف البلورة بأنھا منتظمة.
– تتمیز البلورات المكعبة وغیر المتبلرة بأن لھا خواص متماثلة ممیزة في جمیع الإتجاھات، ویعتمد حجم البلورات وكمالھا على سرعة تكوینھا.
المراجع: أسس الكيمياء العامة والفيزيائية – خواص السوائل وخواص المواد الصلبة – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.








المصادر