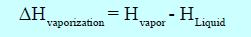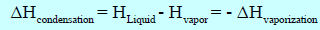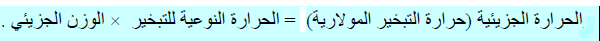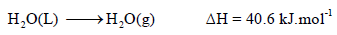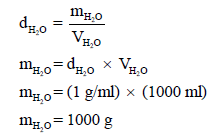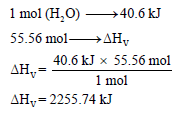الحرارة الكامنة للتبخر (حرارة التبخير) Enthalpy of Vaporization
الحرارة الكامنة للتبخر Latent Heat of Vaporization
حرارة (انثالبي) التبخر(التبخير)Heat (Enthalpy) of Vaporization
– نفرض أننا وضعنا قدراً من سائل ما في حیز مقفل، فإن ھذا السائل سوف یكون لهضغط بخاري معين عند درجة حرارة معینة. ولنفرض أننا وصلنا الفراغ الواقع فوق سطح السائل بمضخة ماصة، فإن البخار الواقع فوق سطح السائل سیزاح، مما یؤدي الى اختلال عملیة الإتزان السابقة، وینتج عن ذلك صعود عدد آخر منجزیئات السائل لیملأ ھذا الفراغ، وزیادة عدد الجزیئات الصاعدة من سطح السائلعلى عدد الجزیئات العائدة إلیه.
– نظراً لأن الجزیئات ذات الطاقة العالیة ھي التي تترك سطح السائل، فإن متوسط الطاقة الحركیة للجزیئات التي تبقى في السائل سوف یقل. ویعني ذلك أن درجة حرارة السائل ستنخفض بالتبخیر، وإذا أرید إجراء عملیة التبخر دون تغیر في درجة حرارة السائل، فلا بد من تزوید السائل بطاقة من الخارج لحفظ درجة حرارته ثابتة.
– یطلق على كمیة الحرارة التي یزود بھا السائل لتبخیره دون رفع درجة حرارته باسم الحرارة الكامنة للتصعید (للتبخیر Latent Heat of Vaporization“. وھي تقاس عادة بعدد السعرات اللازمة لتبخیر واحد جرام من السائل دون رفع درجة حرارته.
تعريف الحرارة النوعية للتبخر (للتبخير)
– من الضروري لكي تترك الجزیئات سطح السائل متحولة الى الحالة البخاریة أن تتغلب على قوى جذب جزیئات السوائل الأخرى. وھذه القوى كبیرة نسبیاً نظراً لأن الجزیئات تكون أكثر التصاقاً في السائل بالمقارنة بالحالة البخاریة. ویشترط أن تكون درجة الحرارة أدنى من الدرجة الحرجة.
– تعرف الحرارة النوعیة للتبخیر بأنھا: كمیة الحرارة اللازمة التي یمتصھا جرامواحد من السائل لیتحول الى بخار عند درجة الغلیان.
– تقاس الحرارة النوعية للتبخير بوحدة J/g أو cal/g
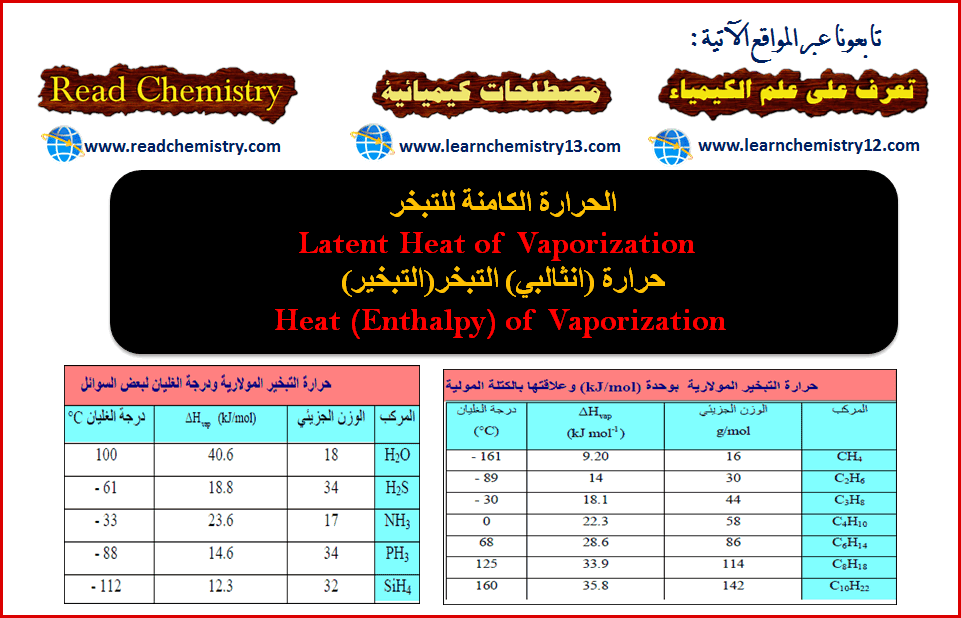
– تختلف كمیة الحرارة النوعیة باختلاف درجة الحرارة التي یتم عندھا التبخیر. فعند 100Coتكون الحرارة النوعیة للماء (540cal/g) وهي نفس كمیة الحرارة المنطلقة عندما یتكثف جرام واحد من البخار الى سائل عند درجة 100Co . وتكون للبنزين (94cal/g) ، وللكلورفورم (59cal/g) وللكحول الإيثيلي (204cal/g)وللزئبق (71cal/g).
تعريف حرارة التبخير المولارية (Molar Heat of Vaporization) ∆Hvap
– حرارة التبخیر المولاریة (أو المولیة) ھي كمیة الحرارة اللازمة لتحویل مول واحد من سائل ما الى بخار عند درجة حرارة ثابتة (درجة الغلیان). ویرمز لھا بالرمز ∆Hvap ووحدتها (J/mol or cal/mol)
– وفي ھذه الحالة فھو تغییر في المحتوى الحراري (الكمیة الإجمالیة للطاقة الحراریة) لمادة ما أثناء تعرضھا للتغیر من سائل الى بخار. ویساوي ھذه التغیر في المحتوىالحراري للطاقة التي تحتویھا المادة في حالتھا النھائیة (البخار) مطروحاً منه الطاقةالتي كانت تمتلكھا في حالتھا الأولیة (السائلة) وھكذا فإن:
ومن الناحیة العملیة فإن كلاً من Hliquid , Hvapor لا يمكن قياسها ، الإ أنه يمكن قياس الفارق بينهما (∆Hvap)
– ویطلق على عملیة تحول الغاز أو البخار الى سائل بالتكثیف (condensation) ویمكن القول ھنا أن عملیة التكثیف ھي عملیة عكسیة للتبخیر:
وحیث أنھا متساویة في القیمة مع (∆Hvap) ولھا علامة معاكسة لـ (∆Hvap) لذا فإن (∆Hcond) لها قيمة سالبة في جميع الأحوال.
التكثيف عملية طاردة للحرارة
أهمية معرفة حرارة التبخير المولارية
– حرارة التبخیر المولاري خاصیة فیزیائیة ھامة لأیة مادة.
– على المھندسین معرفتھا عند قیامھم بتصمیم المصانع الكیمیائیة لأن علیھم معرفة كمیة الطاقة اللازمة لتبخیر مختلف المذیبات المستعملة في العدید من العملیات.
– حرارة تبخیر الماء ھامة لعلماء الأرصاد الجویة وذلك لأن معظم الطاقة الشمسیة الممتصة من قبل الأرض تتجه نحو تبخیر الماء من المحیطات. مما یعني أن تلك الطاقة تصبح مخزونة في بخار الماء وعندما یتكثف الماء تنطلق. وھذا ھو مصدر الكمیات الھائلة من الطاقة التي تحتویه الأعاصیر العنیفة وعواصف الأمطار الأخرى.
مثال: حرارة تبخير الماء 40 kJ/mol . وهذا يعنى أننا نحتاج طاقة مقدارها 40.6 kJ/mol لتحويل مول واحد من الماء السائل عند (100 oC)إلى بخار الماء.
مثال (1): إذا علمت أن حرارة التبخر المولیة للماء ھي (40.6 kJ/mol) . فأوجد الطاقة اللازمة لتبخیر لتر من الماء (1 dm3) حیث أن كثافة الماء تساوي (1 g/ml).
الحل:
نوجد عدد الجرامات من الماء (وزن الماء) الموجود في لتر منه بقانون الكثافة:
نحول ھذا العدد الى مولات من العلاقة:
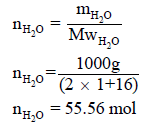
ومن السؤال فإن حرارة التبخیر لمول واحد من الماء ھي 40.6 kJ/mol وبالتالي فحرارة التبخير لـ 55.56 mol
العوامل المؤثرة على حرارة التبخير
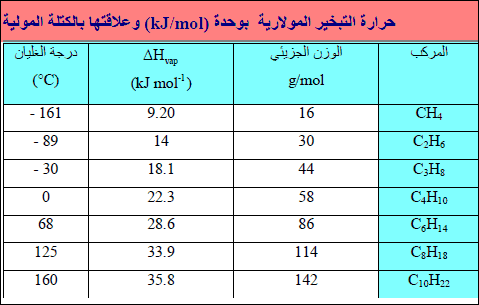
أولاً: أثر الوزن الجزیئي على حرارة التبخیر
– بزیادة الوزن الجزیئي یزداد التجاذب بین الجزیئات وبذلك تزداد حرارة التبخیر.
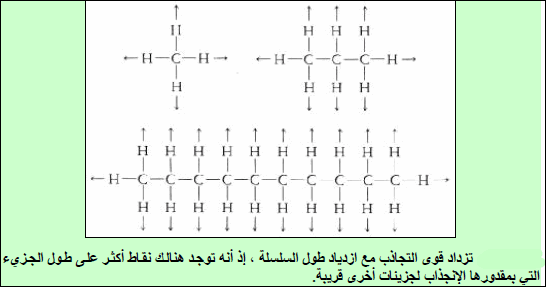
– إذا نظرنا المتسلسلة الھیدروكربونیة CH4 إلى C10H22 نلاحظ ازدياداً مضطرداً في (∆Hvap)مع ازدیاد الوزن الجزیئي. وھذه المركبات لا قطبیة، لذلك فقوى التجاذب الوحیدة الموجودة بین الجزیئات ھي قوى لندن، فعلى ھذه إذاً تزداد أیضاً من CH4 إلى C10H22
– بالإمكان فھم السبب عن طریق تفح صبنیة الجزیئات، فھذه الھیدروكربونات ( جزیئات تشابه السلسلة).
– یزداد طول سلسلة الكربون بتقدمنا من CH4 إلى C10H22. ولھذا بدوره تأثیر على زیادة المواقع على طول الجزيء حیث یمكن لقوى لندن أن تحدث مع جزیئات أخرى. فجزيء طویل مشابه لسلسلة یتم ربطه إذاً في أماكن أكثر من تلك الأماكن للجزيء القصیر. وبالتالي یتوجب تزوید طاقة أكثر لنزع مثل ھذه الجزیئات الطویلة السلسلة من السائل.
النتیجة ھو أنه كلما ازداد طول السلسلة ازدادت قیمة (∆Hvap)
ثانياً: أثر حجم الجزیئات على حرارة التبخیر
أولاً: أثر حجم جزئيات الهالوجينات على حرارة التبخير
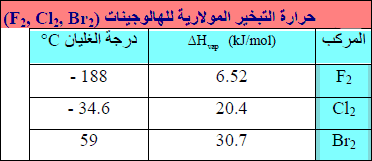
– الحجم الجزیئي من العوامل الأخرى التي تؤثر في شدة قوى لندن. فإذا تفحصنا جزیئات لھا نفس الصیغة العامة، مثل الھالوجینات (Br2 , Cl2 , F2) نجد أن الجزیئات الكبیرة التي لھا (∆Hvap) أعظم من الجزیئات الصغیرة.
– كلما تقدمنا من F2 إلى Br2 تصبح الذرات التى تكون الجزيئات أكبر، وهكذا تصبح الجزیئات أیضاً أكبر.
– وكلما ازداد الحجم، تصبح الإلكترونات الخارجیة أبعد عن النواة، وبالتالي لیست ممسوكة بنفس الشدة. وبسبب ھذا فإن الغمامة الإلكترونیة لجزيء كبیر یسھل تشویھھا أو استقطابھا. كما أنه من الأسھل إحداث ثنائیات القطب اللحظیة المسؤولة عن قوى لندن (یشار الى سھولة تشویه الغمامة الإلكترونیة بالتعبیر قابلیة الإستقطاب Polarizability).
– والنتیجة ھي أن قوى لندن بین الجزیئات المركبة من ذرات ضخمة سھلة الإستقطاب مثل البروم أقوى منها بین الجزیئات المركبة من ذرات صغیرة مثل الفلور. ولھذا السبب تزداد (∆Hvap) من F2 إلى Br2
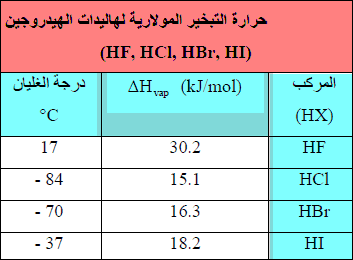
– عند النظر في ھالیدات الھیدروجین(HF, HCl, HBr, HI) نجد أن التغير المتوقع لقيم (∆Hvap) مع الحجم الجزيئي معكوس.
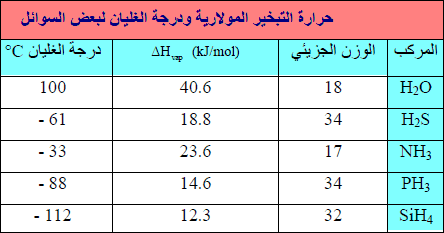
ثانياُ: أثر حجم المركبات ((H2O, NH3, H2S, PH3 على حرارة التبخير
– إذا قارنا بين ((H2O, NH3, H2S, PH3 كما بالجدول التالي . نري أن الترابط الهيدروجينى مهماُ جداً في حالتى (H2O , NH3) حيث أنه السبب في رفع قيمة حرارة التبخير لهما مقارنة بـ (H2S , PH3) بالرغم من أنهما أقل منھما في الوزن الجزیئي لكن وجود الرابطة الھیدروجینیة رفع من قیمة حرارة التبخیر لھما.
– إن الأكسجین والنیتروجین والفلور كلھا ذات أحجام صغیرة جداً كما أنھا من العناصر الأكثر سالبیة بكثیر. فلیس من المستغرب إذاً أن یكون الترابط الھیدروجیني هاماً في حال (NH3 , HF , H2O)
– یتم التوصل الى التصرف الطبیعي في ھیدریدات المجموعة (IVA) حيث يكون (∆Hvap) لمركب CH4
أقل من (∆Hvap) لمركب SiH4. فهنا ليس لمركب CH4 ولا لمركب SiH4 ميل نحو إقامة ترابط ھیدروجیني لأن كلیھما لا قطبي .
ثالثاً: أثر قطبیة الجزیئات على حرارة التبخیر
رابعاً: أثر وجود الروابط الھیدروجینیة على حرارة التبخیر
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.