قائمة بأهم موضوعات الكيمياء الحرارية Thermochemistry
مقدمة عن الكيمياء الحرارية Introduction of Thermochemistry
– یعتبر إنتاج الطاقة واحداً من أھم المزایا التي ترافق وتمیز التفاعلات الكیمیائیة. فكل تفاعل كیمیائي یخضع لقانونین رئیسین ھما : قانون حفظ المادة، وقانون حفظ الطاقة.
– فعندما یأكل شخص ما الحلوى فإن محتویاتھا ، وخصوصاً السكر، تتفاعل مع الأكسجین لإنتاج H2O , CO2 وینبعث نتیجة لھذا التفاعل طاقة حراریة تساعد الجسم على القیام بتحریك عضلاتھ وتحافظ على درجة حرارة مناسبة للجسم.
– وھناك أمثلة كثیرة في ھذه الحیاة على التفاعلات الطاردة أو الماصة للحرارة، فمثلاً تنبعث حرارة كبیرة عند حرق الفحم الحجري والغاز الطبیعي ومشتقات البترول الأخرى وتستخدم ھذه الحرارة أو الطاقة في نواحي الحیاة المختلفة.
– وھناك أیضاً بعض التفاعلات الكیمیائیة التي تمتص الحرارة ومنھا تفكك الماء لتحضیر الأكسجین والھیدروجین. والإنسان على كوكب الأرض ینتج أكثر من % 90 من الطاقة (من التفاعلات الكیمیائیة) وخصوصاً تلك الناتجة من حرق الفحم والبترول والغاز الطبیعي.
– یسمى العلم الذي یبحث في الطاقة وتغیراتھا بالدینامیكا الحراریة ( (Thermodynamics ویدرس ھذا العلم في الكیمیاء والفیزیاء والھندسة والصیدلة وغیرھا من العلوم.
– الذي یھمنا من الدینامیكا الحراریة في ھذا الفصل ھو الجزء الذي یربط تغیرات الطاقة بالتفاعلات الكیمیائیة ویسمى ھذا العلم بالكیمیاء الحراریة (Thermochemistry)
تعريف الكيمياء الحرارية Thermochemistry
تسمى دراسة تغيرات الحرارة في التفاعلات الكيميائية بالكيمياء الحرارية . والكيمياء الحرارية فرع من فروع الكيمياء الفيزيائية المهمة وهي جزء من الديناميكا الحرارية (Thermodynamics) تهتم بــ:
(1) دراسة التغيرات الحرارية المرافقة للتفاعلات الكيميائية والتحولات الفيزيائية.
(2) إيجاد العلاقة بين حرارة التفاعل عند حجم ثابت وحرارة التفاعل عند ضغط ثابت.
أهداف الكيمياء الحرارية
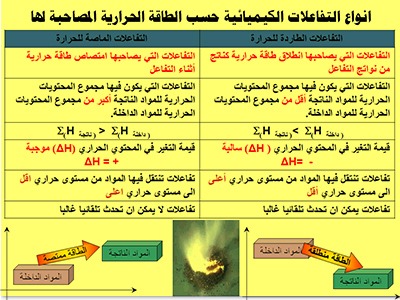
(أ) تفاعلات طاردة للحرارة : (Exothermic Reactions)
وهي تلك التفاعلات التي يصاحبها انطلاق (انبعاث) كمية من الحرارة .
مثال: اتحاد غاز الهيدروجين وغاز النيتروجين لتكوين غاز النشادر
(ب) تفاعلات ماصة للحرارة : (Endothermic Reactions)
مقارنة بين التفاعلات الطاردة للحرارة والماصة للحرارة
قائمة لأهم الموضوعات للكيمياء الحرارية Thermochemistry