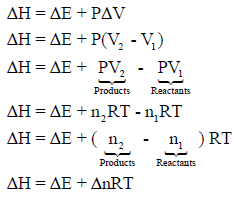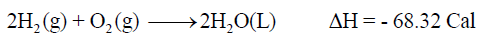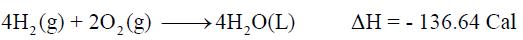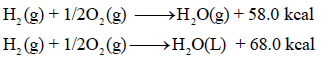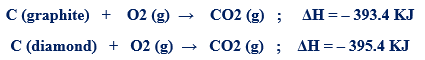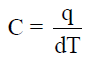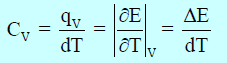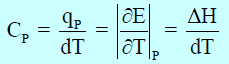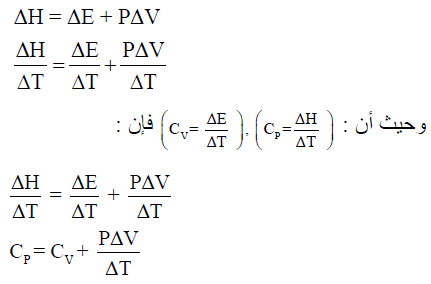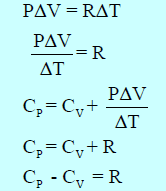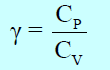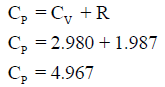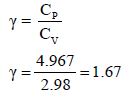حرارة التفاعل – العوامل المؤثرة على حرارة التفاعل
– یعتمد التغیر الحراري المصاحب للتفاعل على نوع التفاعل، والظروف التي یتم عندھا ذلك التفاعل. ومن أھم العوامل المؤثرة على حرارة التفاعل أو انثالبي التفاعل Factors Affecting Enthalpy of Reaction هي كما يلي:
محتويات الموضوع
العوامل المؤثرة على حرارة التفاعل
من أھم العوامل المؤثرة على حرارة التفاعل أو انثالبي التفاعل Factors Affecting Enthalpy of Reaction هي كما يلي:
(1) الضغط والحجم Temperature and Volume
(2)كمية المواد المتفاعلة Quantity of Reactants
(3) الحالة الفيزيائية لكل من المواد المتفاعلة والناتجة
(4) الأشكال التآصلية Allotropic Modification
(5) الحرارة النوعية للمواد أو السعة الحرارية
وسيتم مناقشة كلاً منهما على حدا كما يلي:
(1) الضغط والحجم Temperature and Volume
– وھذا العامل له أھمیة كبیرة في حالة التفاعلات التي تشتمل على غازات.
– ففي التجارب العملیة التي تجرى تحت ضغط ثابت، إما أن یبقى النظام مفتوح اً للجو (معرضاً للضغط الجوي وھو ضغط ثابت)، أو یحدث التفاعل في إناء یبقى علیه الضغط الخارجي ثابتاً.
– التغیر الحراري لتفاعل یتم عند ضغط ثابت یعزى الى الفرق في المحتوى الحراريΔHبين نواتج التفاعل والمواد المتفاعلة.
– بینما یعزى التغیرالحراري لتفاعل يتم عند حجم ثابت الى الفرق بین مجموع الطاقات الداخلیة لنواتج التفاعل ومجموع الطاقات الداخلیة للمواد المتفاعلة.
– وإذا رمزنا للطاقة الداخلیة بالرمز ΔEفإن:
- الحرارة عند حجم ثابت: ΔEqv =
- ضغط ثابت الحرارة عند: ΔHqp =
– والعلاقة التي تربطھما (كما أخذناها في الثیرمودینامیك) ھي كما يلي:
ΔE + PΔV = ΔH
حیث أن P: الضغط ، ΔV: التغير في الحجم
– بالنسبة للتفاعلات التي تشمل على مواد صلبة أو سائلة فقط، فإن التغیر في الحجم الذي یصاحب تلك التفاعلات یكون عادة بسیطاً جداً لدرجة أنه یمكن إھماله، أي أن : ΔV ̴ 0 ( مالم يكن الضغط كبيراً جداً) وحيئنذ فإنΔE = ΔH
– أما بالنسبة للتفاعلات التي تشتمل على غازات، فإنه في ھذه الحالة یكون التغیر في الحجم كبیراً ولا یمكن إھماله، وبفرض أن الغاز مثالي فإن:
– حيث Δn تمثل التغیر في أعداد مولات النواتج والمواد المتفاعلة والموجودة في الحالة الغازیة فقط.
– وعندما يكون )Δn = 0أي عدد المولات النواتج الغازیة یساوي عدد مولات المتفاعلات) فإن:ΔE = ΔH
(2) كمية المواد المتفاعلة Quantity of Reactants
– تتناسب حرارة التفاعل (الممتصة أو المنبعثة) تتناسب طردیاً مع كمیات المواد المتفاعلة.
– فكلما زادت أو تضاعفت كمیات المواد المتفاعلة ، زادت أو تضاعفت كمیات الحرارة الممتصة أو المنطلقة من التفاعل.
– عند احتراق (2 mol) من الهيدروجين ، فإنه تنطلق كمية حرارة قدرها (68.32 Cal) كما بالمعادلة الآتية:
– أما عند احتراق (4 mol) من الهيدروجين (ضعف الكمية السابقة) فإنه تنطلق كمية حرارة قدرها (136.64 Cal) كما بالمعادلة الآتية:
– أي أن كمية الحرارة المنطلقة عن احتراق (4 mol) من الهيدروجين تكون ضعف كمية الحرارة المنطلقة عند احتراق (2 mol) من الهيدروجين. وهذا يؤكد أن حرارة التفاعل تتوقف على كميات المواد المتفاعلة.
(3) الحالة الفيزيائية لكل من المواد المتفاعلة والناتجة
Physical State of Reactants and Products
– لقد وجد أن الحالة الفیزیائیة للمادة سواء كانت متفاعلة أو ناتجة لھا تأثیر كبیر عى التغیر الحراري الحادث والمصاحب للتفاعل.
– عند تفاعل غاز الأكسجین وغاز الھیدروجین لتكوین الماء في الحالة السائلة، تتصاعد كمیة من الحرارة أكبر من تلك المنطلقة عند تكوین الماء في الحالة الغازیة كما یتضح من المعادلات التالیة:
حیث استھلك الفرق بینھما في تحویل الماء المتكون من حالته السائلة الى الحالة الغازیة.
(4) الأشكال التآصلية Allotropic Modification
– تختلف حرارة احتراق الكبریت المعیني عن حرارة احتراق الكبریت المنشوري، والفرق بینھما عبارة عن حرارة تحویل الكبریت المعیني الى المنشوري، أو العكس.
– كذلك تختلف حرارة التفاعل في حالة الجرافيت عنها في الماس على الرغم من أنهما كربون (Allotropic Modification) كما في المعادلات الآتية:
(5) الحرارة النوعية للمواد أو السعة الحرارية
Specific heat and Heat Capacity
– لا یقتصر امتصاص الحرارة على التغیرات الفیزیائیة والكیمیائیة فقط، بل في رفع درجات الحرارة أیضاً.
– تعرف الحرارة النوعیة لمادة بأنھا كمیة الحرارة اللازم لرفع درجة حرارة جرام واحد من المادة درجة مئویة واحدة.
– وبما أن الحسابات في العادة تجرى على أساس الأوزان الجزیئیة الجرامیة (المولات) فمن الملائم استعمال السعة الحراریة الجزیئیة، وھي عبارة عن الحرارة النوعیة مضروبة في الوزن الجزیئي للمادة.
– وتعرف السعة الحراریة الجزیئیة بأنھا كمیة الحرارة اللازمة لرفع درجة حرارة جزيء جرامي واحد من المادة درجة مئویة واحدة عند درجة الحرارة المعطاة.
– ووحدة السعة الحراریة ھي Cal/mol Coأو J/mol Co
– ویمكن التعبیر عن السعة الحراریة ریاضیاً كما یلي:
تعیین السعة الحراریة المولیة
– یمكن تعیین السعة الحراریة الجزیئیة (المولیة) عند حجم ثابت أو ضغط ثابت.
فإذا سخنت المادة تحت ظروف یظل عندھا حجمھا ثابتاً، فإن السعة الحراریة الجزیئیة عند حجم ثابت (CV)
– یمكن التعبیر عنھا ریاضیاً كما یلي:
أما السعة الحراریة عند ضغط ثابت (CP)فهي تساوي:
– ولا تحوي السعة الحراریة عند الحجم الثابت (CV)إلا الحرارة الممتصة في زیادة الطاقة الداخلیة.
– السعة الحراریة عند ضغط ثابت (CP)فهي أكثر من (CV) لأنها تحوي بالإضافة إلى ھذه الحرارة مقدار الشغل المبذول في التمدد.
– وبالتالي فإن السعة الحراریة عند ضغط ثابت (CP)أكبر من السعة الحرارية عند حجم ثابت (CV)بمقدار كمية الشغل المبذول في التمدد عندما ترتفع درجة الحرارة بقدار درجة مئوية واحدة.
– وبعبارة أخرى ، فإنه عند ضغط ثابت، یلزم لرفع درجة حرارة كتلة معینة من المادة، كمیة أكبر من الحرارة أكبر من تلك التي تلزم عند حجم ثابت.
– وبالنسبة لمول واحد من غاز، نجد أن :
ΔE + PΔV = ΔH
وبالقسمة على ΔT فإن المعادلة السابقة تصبح:
ومن قانون الغاز المثالي لمول واحد من الغازات فإن :
R هو ثابت الغازات العام (R = 1.987 Cal/mol K = 8.314 J/mol K)
أي أن السعة الحراریة لمول واحد من غاز مثالي عند ضغط ثابت تكون أكبر من قیمة السعة الحراریة له عند حجم ثابت بمقدار R
ويرمز للنسبة CP/CVبالرمز “γ” أي أن:
مثال: إذا علمت أن (R= 1.987) وقيمة CVللغازات أحادية الذرية تساوي 2.98 فاحسب:
(أ) CP (ب) γ
الحل:
(أ)
(ب)
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية