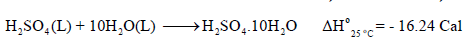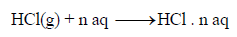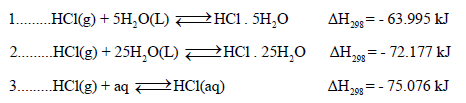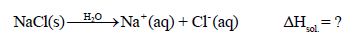حرارة الإذابة (إنثالبي الإذابة) Heat of solution
– في حالات كثيرة جداً نجد أن إذابة المذاب في المذيب ينتج تغيرات في الحرارة يمكن قياسها ويعرف ذلك بحرارة الإذابة Heat of solution
محتويات الموضوع
تعريف حرارة الإذابة (انثالبي الإذابة) ΔHsol
– حرارة الإذابة هي الحرارة التي تتحرر (تنطلق) أو تمتص عندما تذوب كمیة محددة من مذاب في كمیة محددة من المذیب.
– أو هي التغير في الأنثالبي (كمية الحرارة الممتصة أو المنبعثة) الناتج عند إذابة مول (جزئ جرامي واحد) من المادة المذابة (Solute) في كمية وفيرة من المذيب (Solvent) حیث لا یحدث أي تغیر في حرارة المحلول عند تخفیفه.
–عند إذابة مادة ما في مذیب معین ، فإنه یحدث تغیر حراري. بمعنى أنه یصاحب عملیة الإذابـة إما امتصاص حرارة أو انطلاق حرارة.
– فمن الثابت أن حرارة إذابة كلوريد الأمونيوم (NH4Cl) موجبة. أي أنه يذوب في الماء مع امتصاص حرارة. ويمكن ملاحظة ذلك عملياً من برودة الإناء الذي تتم فيه عملية الإذابـة.
– بينما نجد أن حرارة إذابة هيدروكسيد الصوديوم (NaOH) سالبة. أي أنها تذوب في الماء مع إطلاق حرارة نشعر بها من خلال سخونة الإناء الذي تتم به عملية الإذابـة.
– تعتمد قيمة التغير الحراري عند درجة حرارة وضغط معينين على كمية المذيب الذي تحدث فيه الإذابـة.
– ولذلك يلزم تحديد عدد مولات المذيب لكل مول من المذاب عند الإشارة إلى حرارة الإذابة.
كيفية كتابة معادلات حرارة الإذابة
– تعتبر حرارة الإذابة ھي التغیر الحراري الناشيء عن إضافة كمیة معینة من مذاب نقي الى كمیة معینة من مذیب، عند ظروف من درجة الحرارة والضغط الثابتین.
– ویمكن أن تمثل العملیة كما بالمعادلة التالیة:
– الرمز(aq) يمثل المذيب وهو هنا الماء. والرمز (n) هي عدد مولات المذيب علماً بأن كمية الحرارة المنطلقة تعتمد على قيمة (n) كما هو موضح في المعادلات الآتية:
– وفي كل حالة من الحالات الثلاث السابقة – فإن الحرارة المنطلقة لكل مول من المذیب هي حرارة الإذابـة الصحیحة عند ھذه الظروف.
– والقيمة الأخيرة في المعادلة (3) ھي عبارة عن الحرارة الكلیة المنطلقة من عملیة الإذابة. والمقطع (aq) تمثل محلولاً مائياً مخففاً لدرجة أن أي تخفيف آخر لا ينتج عنه تأثيرات حرارية.، وتسمى قيمة ΔH الناتجة بحرارة الإذابة الحقيقة لحمض HCl.
العمليات التي تصاحب عملية الإذابة
عند إذابة مذاب ما في مذیب معین، فإنه تحدث عملیتان وھما كما يلي:
(1) عملیة ماصة للحرارة
– وھي العملیة التي تصاحب تكسیر ھیكل البلورة المذابة الى أیونات منفردة في المحلول (بالنسبة للمركب الأیوني)، أو الى جسیمات دقیقة (بالنسبة للمواد العضویة غیر المتأینة، مثل : السكر أو الیوریا).
(2) عملیة طاردة للحرارة
– وهي عملية تحدث لعد تكسير البلورات.
– وهي تنتج عن تجاذب الأيونات الناتجة مع جزئيات المذيب. وتسمى هذه العملية الهيدرة (hydration) أو الإماهة.
حرارة التخفيف Heat of dilution
– عند إذابة مذاب ما في مذیب معین یحدث تغیر حراري. وبتوالي إضافة زیادة من المذیب یحدث تغیر حراري. ویسمى ھذا التغیر الحراري لكل مول من المذاب بحرارة التخفیف عند التركیز المعین.
– حرارة التخفیف ھي كمیة الحرارة التي تنطلق أو تمتص عند تخفیف محلول یحتوي على واحد مول من المذاب في كمیة معینة من المذیب وذلك لتقلیل التركیز الكلي للمذاب.
– إذا كانت عملیة الإذابة في الأصل ماصة للحرارة ثم خفف المحلول فإن حرارة إضافیة سوف تمتص بواسطة المحلول من المحیط. ویصبح العكس أیضاً بالنسبة للعملیات طاردة الحرارة. وبالتالي فإن حرارة إضافیة سوف تحرر إذا أضیف المذیب لتخفیف المحلول.
– مما سبق فإنه ینبغي الحذر في تخفف المحالیل. فمثلاً حمض الكبریتیك المركز یمثل خطورة كبیرة إذا كان یجب تخفیفه بالماء لأنه یمتلك حرارة تخفیف كبیرة في عملیة طاردة للحرارة.
– ویستمر التغیر الحراري الناتج عن استمرار التخفیف، ولكنه یكون بدرجة أقل حتى نصل الى تخفیف معین، لا یحدث بعده تغیر حراري.
– یسمى مجموع التغیرات الحراریة حتى الوصول الى تخفیف لا نھائي بحرارة الإذابة في كمیة لا نھائیة من المذیب، وحینئذ یعبر عن المحلول بالرمز (aq)
– عادة تقدر حرارة الإذابة عند تركيز معين. ثم تقدر حرارة التخفيف حتى التركيزات الأخرى المطلوبة. ثم يخطط رسم بيانى للعلاقة بين التخفيف والتغير الحرارى الناتج.
– يمر المنحنى البياني الناتج حتى تخفيف لا نهائي (التركيز يساوي تقريباً صفر) وحينئذ نحصل على قيمة التغير الحراري الكلي الناتج عن إذابة جزئ جرامي من المذاب في كمية لا نهائية من المذيب.
أمثلة توضيحية على حرارة الأذابة
حرارة إذابة المركبات الأیونیة في الماء (مثل NaCl)
– طالما ظل NaCl صلباً فإن أيونات (Na+ , Cl–) سوف تظل متماسكة بقوة التجاذب بينهما. ولكن عندما تذوب بلورات NaCl في الماء فإن الشبكة الأيونية ثلاثية الأبعاد سوف تتفكك إلى وحداتها.
– وتستقر أيونات (Na+, Cl–)المفردة في المحلول عن طریق التأثیر التبادلي مع جزیئات الماء حیث تصبح ھذه الأیونات مماھة.
– الإماھة ھي العملیة التي یحاط فیھا الأیون (أو الجزیئ) بجزیئات الماء.
– ودور الماء ھنا دور عازل الكھرباء أي أن جزیئات الماء تحجب الأیونات Na+, Cl–)( من بعضھا البعض وبالتالي تقلل من التجاذب الإلیكتروستاتیكي بینھما والذي كان یجبرھما على التماسك في حالة الصلابة.
– وتعرف حرارة المحلول بالعملیة الآتيىة كما يلي:
– ومن التجربة فإن عملیة الإذابة لكلورید الصودیوم عملیة ماصة للحرارة قلیلاً لذلك نلاحظ أن الكأس الذي تمت فیه إذابة كلوريد الصوديوم صار بارداً بعض الشيء.
المراجع – أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي. ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية