الإنثالبي ΔH – المحتوى الحراري Enthalpy
– في هذا الموضوع سيتم مناقشة موضوع تفصيلى عن الإنثالبي (المحتوى الحراري) Enthalpy وبعد التعريفات المتعلقه به.
محتويات الموضوع
حرارة التفاعل Heat of reaction
– یعتبر التفاعل الكیمیائي (أو التغیر الفیزیائي) ناشراً (طارداً) للحرارة (Exothermic) عندما تنطلق كمیة من الحرارة من النظام الى المحیط وبذلك فإن وعاء التفاعل (النظام) سوف یسخن.
– بینما یعتبر التفاعل الكیمیائي ماصاً للحرارة (Endothermic) عندما یمتص النظام كمیة حرارة من المحیط، وبذلك فإن وعاء التفاعل سوف یبرد.
– ویرمز للحرارة الممتصة أو المطرودة بالرمز (q) حیث أن:
- (q = + ve) عندما تمتص الحرارة من قبل النظام، ویكون التفاعل حینھا ماصاً للحرارة.
- (q = – ve) عندما یكون التفاعل طارداً للحرارة.
تعريف حرارة التفاعل
– حرارة التفاعل هي كمیة الحرارة الممتصة أو المنبعثة عندما یتفاعل جزيء جرامي واحد (مول واحد) من مادة مع جزيء جرامي واحد من مادة أخرى، من مواد تحددھا مواد التفاعل.
أو
– ھي التغیر في الإنثالبي (ΔH) عندما یتفاعل جزيء جرامي من مادة مع جزيء جرامي من مادة أخرى، من مواد تحددھا معادلة التفاعل.
أمثلة لتفاعلات طاردة للحرارة
– لديك التفاعل التالي:
– تنطلق من التفاعل السابق كمیة من الحرارة مقدارھا 890 kJ ، وبالتالي فالتفاعل طارد للحرارة.
– تعادل مول واحد من حمض الكلور HCl مع مول من ھیدروكسید الصودیوم NaOH ینتج حرارة مقدارھا 13.7 kCal (مايعادل 57.5KJ).
أمثلة لتفاعلات ماصة للحرارة
– لدیك التفاعل التالي:
– تمتص في ھذا التفاعل كمیة من الحرارة مقدارھا 181 kJ ، وبالتالي فإن التفاعل ماص للحرارة.
– اتحاد (0.5 mol) من النيتروجين (N2) مع (0.5 mol) من الأكسجين (O2) يحتاج إلى حرارة مقدارها 21.6 kCal (مايعادل 90.37)
الإنثالبي (المحتوى الحراري) Enthalpy
– تحدث معظم التغیرات الكیمیائیة والفیزیائیة تحت ظروف ضغط ثابت ھو الضغط الجوي.
– ففي المعمل مثلاً نجد أن التفاعلات عادة ما تجري في الأنابیب أو الدوارق والتي تترك مفتوحة مع محیطھا وبالتالي تتعرض لضغط ھو تقریباً الضغط الجوي.
– ویعبر الكیمیائیون عن كمیة الحرارة التي تمتص أو تنبعث بواسطة عملیات عند الضغط الثابت بالأنثالبي (H) حیث أن أنثالبي التفاعل یساوي الفرق بین الأنثالبي للنواتج والأنثالبي للمتفاعلات.
– الإنثالبي أو المحتوى الحراري ھو الطاقة المختزنة في مول من المادة، ورمزه (H) وھو خاصیة ممیزة للمادة (تماماً كالكتلة والحجم)، فكل مادة لھا كمیة محددة من الإنثالبي.
– ویعتمد مقدار الإنثالبي للمادة على كمیة المادة، فمولان من المادة یحتوي كمیة من الإنثالبي ضعف ما یحتویه مول واحد من المادة.
– ویكون التغیر في الإنثالبي ΔH عند ضغط ثابت یساوي الفرق بین الإنثالبي في نھایة العملیة (انثالبي النواتج) والإنثالبي عند البدایة (انثالبي المتفاعلات) أي أن:
Hf – Hi =ΔH
حيث Hf قیمة الإنثالبي النھائیة ، Hi قیمة الإنثالبي الإبتدائیة.
– والتغیر في الإنثالبي یساوي الحرارة المنطلقة أو الممتصة خلال العملیة عند ضغط ثابت أي أن:
qp = ΔH
حيثqp كمیة الحرارة عند ضغط ثابت
حساب قيمة الإنثالبي ΔH للتفاعلات
– یمكن حساب التغیر في الإنثالبي ΔH للتفاعل بطرح انثالبي المواد المتفاعلة من انثالبي المواد الناتجة كما يلي:
Pتعني Products أي النواتج ، R تعني Reactants أي المتفاعلات.
np = عدد مولات المواد الناتجة ، nR = عدد مولات المواد المتفاعلة.
(ΔH)p = انثالبي النواتج ، (ΔH)R = انثالبي المتفاعلات
– وعند كتابة قیمة الإنثالبي في المعادلة فإنھا تعرف بالمعادلة الكیمیائیة الحراریة (thermochemical equation) كما في المثالین التالیین:
– في التفاعل الأول قیمة التغیر في الإنثالبي بالسالب (ΔH = – 890kJ) وبالتالي فإن التفاعل طارد للحرارة. وفیه یكون انثالبي المواد الناتجة أقل من انثالبي المواد المتفاعلة كما بالعلاقة الآتية:
– وفي التفاعل الثاني فإن قیمة التغیر في الإنثالبي (حرارة التفاعل) موجبة ( (ΔH = + 181.6 kJ وبالتالي فإن التفاعل یكون ماصاً للحرارة، وحینھا فإن انثالبي المواد المتفاعلة كما بالعلاقة الآتية:
قيم الإنثالبي ΔH وحالة المادة الفيزيائية
– تتغير قيم ΔH مع تغیر حالة أي مادة من المواد المتفاعلة أو الناتجة (صلبة S)) ، سائلة (L) ، غازية (g) ، محلول (aq)
– مثال توضيحي:
– نلاحظ أن كمية الإنثالبي (كمية الحرارة) انخفضت بمقدار (88kJ) في الحالة الثانية عنها في الحالة الأولى ، بسبب أن الماء في المعادلة (2) غازاً ، بينما في المعادلة (1) سائلاً.
اصطلاحات كتابة المعادلات الكيميائية الحرارية
(1) تتحرر (تنطلق) كمیة من الحرارة في حالة التفاعلات الطاردة للحرارة. وإشارة ΔH تكون سالبة.
(2) تمتص كمیة من الحرارة في حالة التفاعلات الماصة للحرارة. وإشارة ΔH تكون موجبة.
(3) تعطي قیم ΔH لتفاعل معین عند الظروف القیاسیة للمادة (P = 1 atm, T = 25ºC) ما لم ینص في المسألة على خلاف ذلك.
(4) تمیز الحالة الفیزیائیة للمواد الموجودة في التفاعل وذلك بوضع الحرف (s, g. L, aq) بعد رمز المادة حيث تعتمد قيمة ΔH على حالات المواد المتفاعلة والناتجة فمثلاً :
(5) إذا عكست معادلة التفاعل فإن إشارة ΔH تنعكس مع بقاء نفس القیمة كما بالمعادلات الآتية:
(6) تعتمد قیمة ΔH في التفاعل الكیمیائي على كمیة المواد المتفاعلة، كما يلي:
– تفاعل (1 mol) من الهيدروجين ينتج طاقة قدرها 242kJ
– بينما تفاعل (2 mol) من الهيدروجين ينتج طاقة قدرها (2 X 242 kJ = 484 kJ)
(7) كمیة الحرارة (q) الناتجة أو الممتصة في أي تفاعل تحت ضغط ثابت تساوي التغير في المحتوى الحراري ΔH
qp = ΔH
تغيرات الإنثالبي القياسية Standard Enthalpy Changes
– تعرف الحالة القیاسیة للمادة بأنھا الحالة الفیزیائیة (صلبة، سائلة، غازیة) التي توجد عندھا المادة بشكل تكون فیه أكثر استقراراً عند ضغط جوي واحد (1 atm) ودرجة حرارة (25 Co) وهي بالكلفن (298K) وھي تمثل درجة حرارة الغرفة تقریباً.
– كما یرمز لتغیر الإنثالبي القیاسي بالرمز ΔHo298 أو اختصاراً ΔHo
– وعادة ما تعطى قيم ΔHo عند درجة حرارة (298K) مالم ينص على خلاف ذلك.
المراجع – أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية


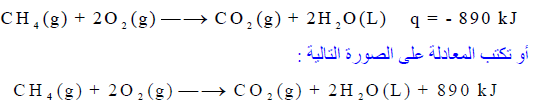
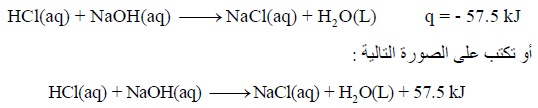
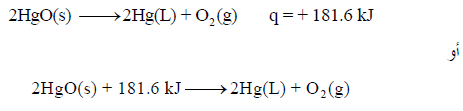
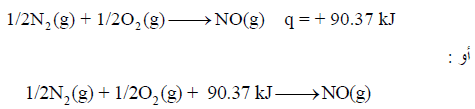
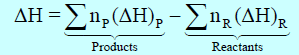
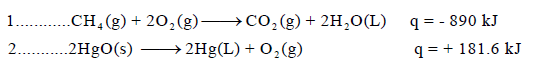
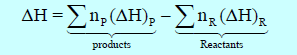
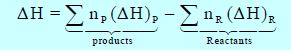
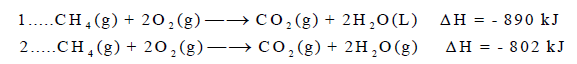
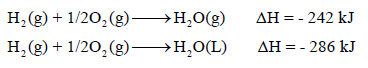
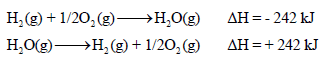
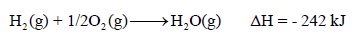
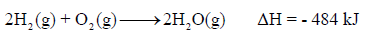





جزاكم الله الف خير على العمل اللي اكثر من رائع
شكراَ أخي وشكراً على دعمك لموقعنا
ما شاء الله على الموقع والله كتير عجبني وعلى جهدك المبذول شكررررررررا ليك اخي
شكرا ليك كتير ونتمنى المزيد