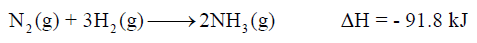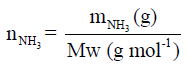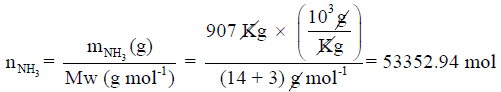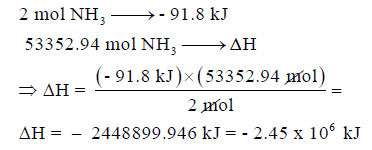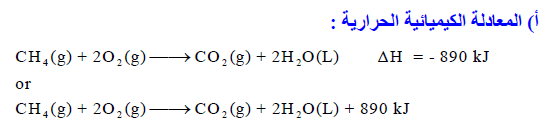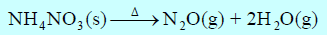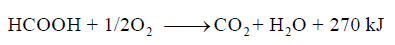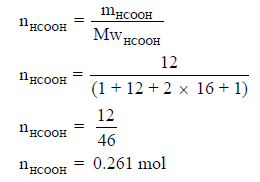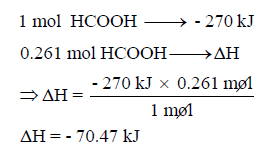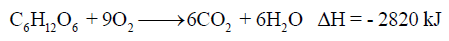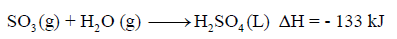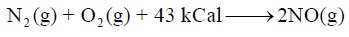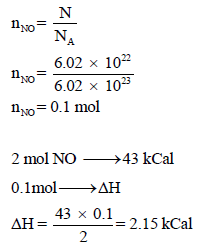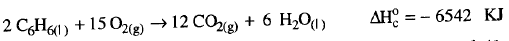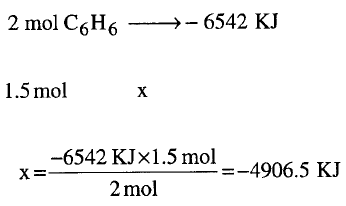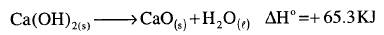مسائل محلولة على الأنثالبي – المحتوى الحراري
مسائل محلولة على الأنثالبي – المحتوى الحراري
– فى هذا الموضوع سيتم مناقشة مسائل محلولة على الأنثالبي – المحتوى الحراري Solved problems on Enthalpy كما نتناول الحلول بأسلوب سهل للتوضيح.
– ولكن قبل البدء فى المسائل وحلها يمكنك مراجعة معلوماتك عن الأنثالبي (المحتوى الحرارى) Enthalpy
مثال (1)
أذيبت كمية من كلورات الباريوم Ba(ClO3)2 في مقدار من الماء عند (25 Co) فإن درجة حرارة المحلول تصبح أقل من (25 Co). فهل عملية الذوبان طاردة ام ماصة للحرارة؟ وما إشارةΔH ؟
الحل:
– انخفاض درجة حرارة المحلول عند ذوبان الملح یبین أن ھذه العملیة (عملیة الذوبان) تمتص الحرارة من المحیط.
– وھكذا فإن العملیة ماصة للحرارة وتكون إشارة ΔH موجبة في ھذه الحالة.
مثال (2)
أحسب كمية الحرارة المنطلقة عندما يتكون (907 kg) من الأمونيا (NH3) نتيجة للتفاعل التالي إذا كان یحدث عند ضغط ثابت:
علماً بأن الكتل الذرية (N = 14 , H = 1)
الحل:
– المعاملات في المعادلة السابقة تعبر عن المولات، فنقول أن واحد مول من النيتروجين يتفاعل مع ثلاث مولات مع الهيدروجين فينتج مولان من النشادر وتنطلق كمية من الحرارة مقدارها 91.8 kJ
– كمية النشادر (الأمونيا) في المسألة معطاة بالكیلوجرامات، ولذلك نحول ھذه القیمة الى مولات بتطبیق العلاقة الآتية كما يلي:
وبالتالي فإن عدد مولات النشادر يكون كما يلي:
ومن ھنا یمكن معرفة كمیة الحرارة المنطلقة من إنتاج ھذه الكمیة بالإعتماد على المعادلة كما يلى:
مثال (3): تابع مسائل محلولة على المحتوى الحراري (الأنثالبي)
يحترق الميثان CH4 في جو من الأكسجين احتراقاً كاملاً وانطلقت كمية من الحرارة مقدارها 890 kJ/mol في الظروف القياسية.
(أ) أكتب المعادلة الكیمیائیة الحراریة لھذا التفاعل.
(ب) أحسب الطاقة الناتجة من احتراق 3 mol من الميثان
(جـ) احسب كمية الحرارة الناتجة عن حرق 36 g من الميثان
علماً بأن الكتل الذرية (C = 12 , H = 1)
الحل:
يكون الحل كما يلي:
مثال (4)
– تتفكك نترات الأمونيوم الصلبة NH4NO3 إلى غازي N2O وبخار الماء وتمتص من كمية من الحراراة مقدارها 37 kJ/mol
(أ) أكتب المعادلة الكیمیائیة الحراریة الموزونة لتفكك نترات الأمونيوم NH4NO3
(ب) احسب كمية الحرارة الممتصة عند تفكك 2.5 g من نترات الأمونيوم NH4NO3
علماً بأن الكتل الذرية (O = 16 , N = 14 , H = 1)
الجواب: 1.16 kJ ، 37 kJΔH= +
مثال (5)
حسب التفاعل التالي كما يلي:
ما حرارة التفاعل الناتجة بالكيلو جول والمصاحبة لإنتاج 100 g من Ca(OH)2 ؟
علماً بأن الكتل الذرية (O = 16 , Ca = 40.1 , H = 1)
الجواب: 473 kJΔH= –
مثال (6): تابع مسائل محلولة على المحتوى الحراري (الأنثالبي)
احسب الحرارة الناتجة من احتراق 12 g من حمض الفورميك (HCOOH) حسب التفاعل:
علماً بأن الكتل الذرية (O = 16 , C = 12 , H = 1)
الحل:
يكون الحل كما يلي:
لا بد من تحویل كمیة حمض الفورمیك من الجرامات الى المولات:
وبالتالي فإن:
مثال (7)
حسب المعادلة التالية كما يلي:
احسب كتلة الجلوكوز C6H12O6 اللازمة لإنتاج 47 kJ من الحرارة. علماً بأن الكتل الذرية (O = 16 , C = 12 , H = 1)
الجواب : 3g
مثال (8)
حسب المعادلة التالية كما يلي:
احسب كمية الحرارة المنطلقة اللازمة لإنتاج 123 g من حمض الكبريت علماً بأن الكتل الذرية (O = 16 , S = 32 , H = 1)
الجواب: 167 kJΔH= –
مثال (9)
ما مقدار الحرارة اللازمة لإنتاج (6.02 x 1022 molecules) من أكسيد النيتريك NO حسب التفاعل التالي:
علماً بأن عدد أفوجادرو NA = 6.02 x 1023
الحل:
يكون الحل كما يلي:
نحول عدد الجزئيات إلى مولات كما يلي:
مثال (10): تابع مسائل محلولة على المحتوى الحراري (الأنثالبي)
يحترق البروبان C3H8 في جو من الأكسجين احتراقاً كاملاً وانطلقت كمية من الحرارة مقدارها 2220 kJ/mol
(أ) أكتب المعادلة الكیمیائیة الحراریة لھذا التفاعل.
(ب) احسب كمية الحرارة المنطلقة من احتراق 10 g من البروبان
علماً بأن الكتل الذرية (C = 12 , H = 1)
الجواب: نفس فكرة المسألة رقم (3)
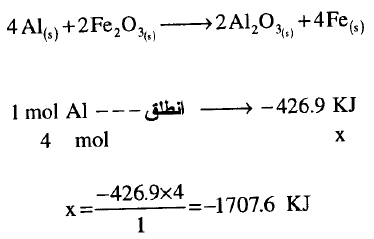
مثال (11)
تفاعل الألمنيوم مع أكسيد الحديد Fe2O3 ونتج بنهاية التفاعل أكسيد الألمنيوم Al2O3 وحديد ، وقد وجد أنه من أجل كل مول من الألومنيوم المستخدم انطلقت كمية من الطاقة قدرها426.9 kJ عند الشروط القياسية.
أكتب المعادلة الثيرموكيميائية التي تبين تفاعل 4 mol من الألومنيوم علماً أن جميع المواد في الحالة الصلبة؟
الحل:
يكون الحل كما يلي:
مثال (12)
تغير الانثالبية القياسيةΔHo للتفاعل التالي ( حرق البنزين السائل) = – 6542 kJ وفق المعادلة كما يلي:
مقاسة تحت شروط قياسية . ما هى قيمة ΔHo من أجل حرق 1.5 mol من البنزين السائل؟
الحل:
يكون الحل كما يلي:
واضح من المعادلة أن كمية الحرارة المنطلقة تعادل احتراق 2 mol من البنزين كما يلي:
مثال (13): تابع مسائل محلولة على المحتوى الحراري (الأنثالبي)
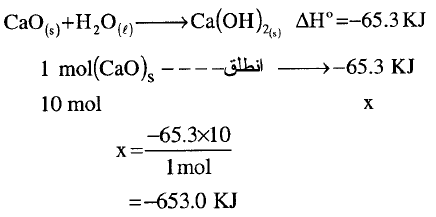
تمثل المعادلة الثرموكيميائية التالية نزع الماء من هيدروكسيد الكالسيوم من اجل تحضير أكسيد الكالسيومCaO المادة الموجودة بالأسمنت:
وأن واحدة من التفاعلات التي تتم في الأسمنت عند إضافة الماء هي عكس المعادلة السابقة.
اكتب المعادلة الثيرموكيميائية من أجل تفاعل 10 mol من أكسيد الكالسيوم مع الماء عند شروط قياسية. ما هى قيمة ΔHo من أجل حرق 1.5 mol من البنزين السائل؟
الحل:
يكون الحل كما يلي:
- أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.
- مبادئ الكيمياء العامة (نظري – مسائل محلولة) / محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش / الطبعة الثانية (2003) / شركة الجا للنشر العلمي – طرابلس.