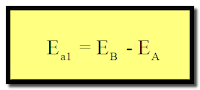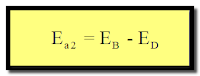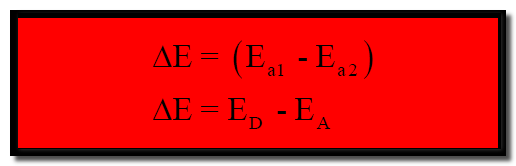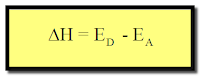طاقة التنشيط Activation Energy
تحتاج جزئيات المواد المتفاعلة كي تتفاعل مع بعضها مقداراً من الطاقة يختلف باختلاف الجزئيات. تسمي هذه الطاقة بطاقة التنشيط Activation energy ويرمز لها بالرمز (Ea).
تعريف طاقة التنشيط Activation Energy
– طاقة التنشيط هي الطاقة اللازمة لتكسير الروابط الموجودة في الجزئيات المتفاعلة أو لتحرير الإلكترونات الخارجية كي تنتقل من ذرة إلى أخري.
– كلما كانت طاقة التنشيط كبيرة يكون التفاعل بطيئاً.
– بينما يكون التفاعل سريعاً كلما كانت طاقة التنشيط صغيرة.
– وفقاً لهذه الفكرة فإن الجزئيات المتفاعلة لا تتحول مباشرة إلى مواد ناتجة. بل يجب أن تكون لديها طاقة كافية للتغلب على حاجز طاقة التنشيط (energy barrier of activation). وهى تشبه التل الذي يجب أن نصل إلى قمته قبل الانتقال إلى الجهة الأخرى . ويمكن توضيح هذه الفكرة بالاستعانة بالشكل التالي:
منحنيات طاقة التنشيط Activation Energy
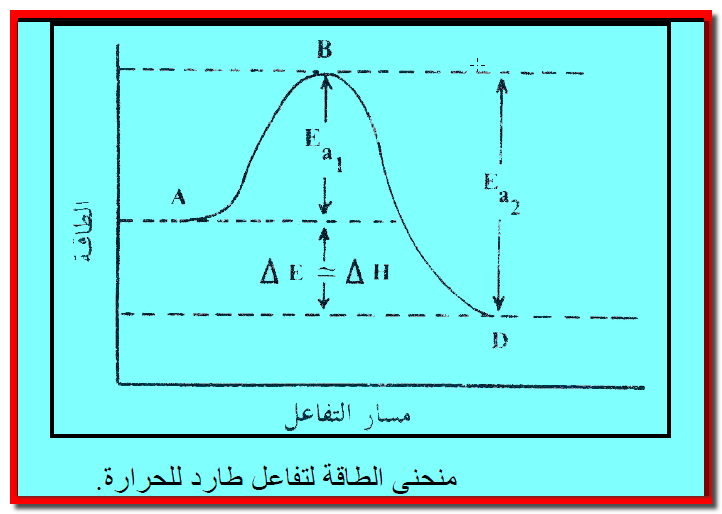
أولاً: طاقة التنشيط لتفاعل طارد للحرارة
– وتمثل النقطة (B) طاقة الجزئيات المنشطة activated state أو الحالة الانتقالية transition state. وهى حالة الجزئيات التي تصادمت وأصبحت لديها طاقة كافية لأن تتحول إلى مواد ناتجة.
– تمثل المسافة (AB) حاجز طاقة التنشيـط (Ea1) وتساوي قيمتها طاقة التنشيـط والتي يمكن تعريفها بأنها: أقل مقدار من الطاقة تحتاجه الجزئيات المتفاعلة عند النقطة (A) لتصل إلى الحالة المنشطة وتكون قادرة على تكوين النواتج ، فالجزئيات التي تتصادم دون أن تكون لديها طاقة مساوية على الأقل لمستوي طاقة النقطة (B) لا يمكن أن تتحول إلى مواد ناتجة.
– يعرف التصادم الذي يؤدي إلى مواد ناتجة بالتصادم المثمر أو النشط.
– يتضح مما سبق أن الجزئيات المتفاعلة لابد وأن تعبر الطريق (ABD) لتكوين النواتج. وأنه لا يمكنها المرور من النقطة (A) إلى النقطة (D) مباشرة. وبتعبير آخر لابد وأن تتغلب الجزئيات المتفاعلة على حاجز طاقة التنشيـط قبل أن تتحول إلى نواتج.
– الطاقة (Ea1) هي الطاقة اللازمة للتفاعل (A→D). وهي تساوي الفرق بين طاقة الحالة النشطة (EB) وطاقة المواد المتفاعلة (EA)
وبذلك يكون الفرق بين (Ea1) ، (Ea2) كالآتي :
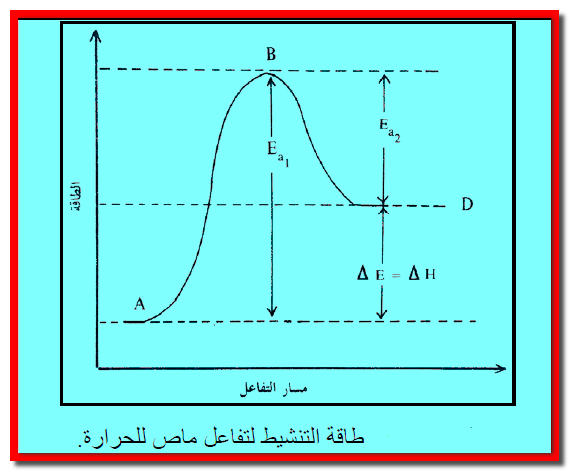
ثانياً/ طاقة التنشيط لتفاعل ماص للحرارة
أما إذا كان التفاعل ماصاً للحرارة فإنه يمثل بالشكل التالي وتكون :
ويتضح من الشكل التالي أن (ED > EA) وبذلك تكون قيمة (ΔH) موجبة ويكون التفاعل ماصاً للحرارة.
تعيين طاقة التنشيط عن طريق التجربة وقيمها للتفاعلات
– لكل تفاعل طاقة تنشيـط معينة يمكن تعيين قيمتها بدقة عن طريق التجربة. وذلك بإجراء التفاعل عند درجات حرارة مختلفة.
– تتراوح قيمة طاقة التنشيـط لمعظم التفاعلات بين 40 ، 200 كيلو جول/مول. وتصل بعضها إلى 625 كيلو جول / مول، وقد تكون ذات قيمة قليلة قريبة من الصفر.
– العامل الرئيسي الذي يحكم قيمة طاقة التنشيـط هو طبيعة المواد المتفاعلة.
أمثلة توضيحية على طاقة التنشيط Activation Energy
مثال توضيحي (1)
– لو كان لدينا خليط من الهيدروجين (H2) والكلور (Cl2) فأنه يمكن تركة عند درجة حرارة الغرفة لمدة طويلة دون أن يحدث تغير.
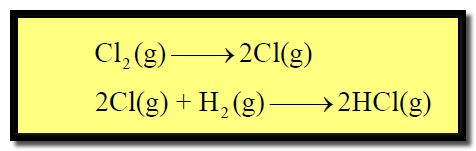
ويطلق التفاعل الأخير كمية من الطاقة كافية لتنشيط مزيد من جزئيات الكلور. وحالما تتمكن الجزئيات القليلة الأولى من الوصول إلى الطاقة المنشطة فإن التفاعل مستمر في الحدوث تلقائياً.
مثال توضيحي (2)
الخلاصة
– أنه إذا كان لدينا كثير من الجزئيات عند درجة حرارة معينة ولديها طاقة كافية لتصل إلى الحالة المنشطة عندما تتصادم فإن التفاعل يكون سريعاً عند تلك الدرجة من الحرارة.
– في بعض الحالات تتفاعل المواد عند درجة حرارة الغرفة بمجرد خلطها مع بعضها، لأنه يوجد عدد كاف من الجزئيات المنشطة عند درجة حرارة الغرفة.
– وفى حالات أخري لابد من إعطاء كمية معينة من الطاقة كافية لتنشيط عدد قليل من الجزئيات التي يمكن أن تتفاعل مصحوبة بانطلاق كمية من الطاقة كافية لتنشيط الجزئيات المتبقية بحيث يستمر حدوث التفاعل.
– وفي بعض الحالات الأخرى لابد من إمداد التفاعل بالطاقة بصورة مستمرة كي تتمكن الجزئيات من الوصول إلى الحالة المنشطة وتحافظ على استمرارية التفاعل.