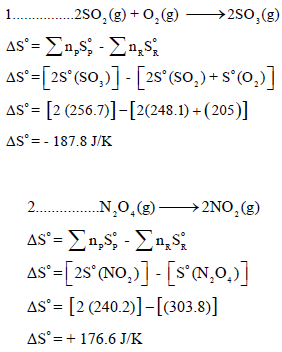الكيمياءالكيمياء الفيزيائية
القانون الثالث للديناميكا الحرارية 3th Law of Thermodynamics
القانون الثالث للديناميكا الحرارية (الأنتروبي القياسي Standard Entropy)
– ينص القانون الثالث للديناميكا الحرارية على أن: (الأنتروبي لأي مادة نقیة متبلورة عند درجة الصفر المطلق
(0 K) یساوي صفراً) وھذا افتراض مبني على أن الجزیئات تكون منتظمة تماماً عند درجة الصفر المطلق ولیس لدیھا أي حركة حراریة.
(0 K) یساوي صفراً) وھذا افتراض مبني على أن الجزیئات تكون منتظمة تماماً عند درجة الصفر المطلق ولیس لدیھا أي حركة حراریة.
– ویمكن أن یصاغ القانون الثالث للديناميكا الحرارية بأنه : (لا یمكن خفض درجة الحرارة لأي نظام إلى درجة الصفر المطلق في عدد محدود من الخطوات).
– عندما ترتفع درجة الحرارة عن الصفر المطلق فسوف یختل النظام بسبب الإثارة الحراریة للجسیمات الكلیة. ویعرف أنتروبي المادة عند ھذه الدرجة بالأنتروبي المطلق (So) ويعني ذلك أن الأنتروبي المطلق (So) لأي مادة في درجة حرارة أعلى من الصفر المطلق ذات قیمة موجبة بسبب فقدان حالة النظام التي تسود فقط عند الصفر المطلق. إذ أنه كلما ارتفعت درجة الحرارة ازداد معھا الأنتروبي المطلق للمادة.
– قیم الأنتروبي القیاسي (So) لبعض المواد محسوبة على أنھا الزیادة الحاصلة في الأنتروبي عندما یسخن مول واحد من المادة بدءاً من حالة متبلورة تماماً عند الصفر المطلق ومروراً بتغیرات عدة مثل الإنصھار والتبخر حتى تصل المادة إلى حالتھا القیاسیة عند درجة حرارة (298 K) وضغط جوي واحد.
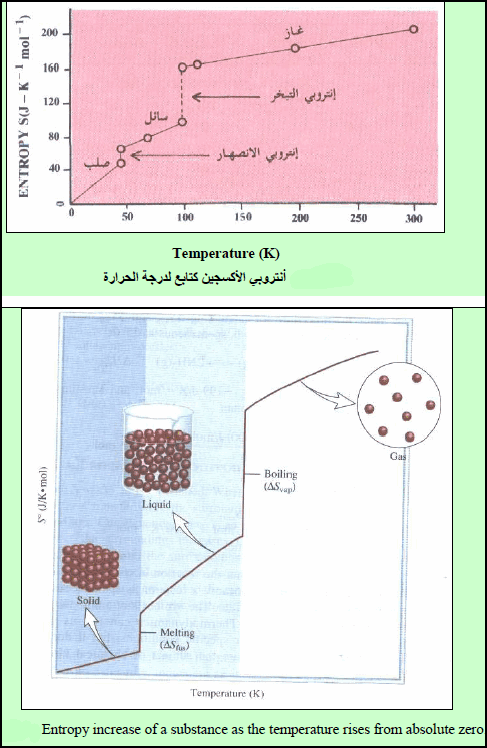
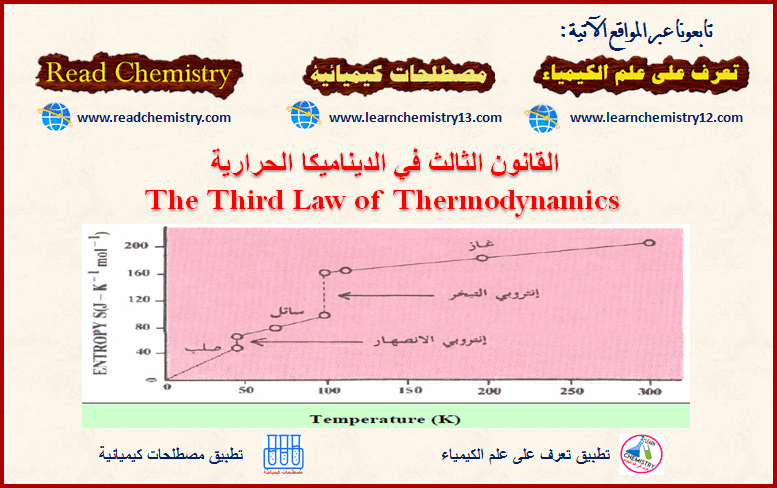
– الشكل التالي یوضح أنتروبي الأكسجین كتابع لدرجة الحرارة ابتداءً من الحالة المنتظمة تماماً للأكسجین. فبزیادة درجة الحرارة فإن الجزیئات تبدأ في الإھتزاز حول أماكنھا وتبدأ حركتھا الحراریة تزداد وبالتالي فإن أنتروبي الأكسجین یزداد.
(1) عند نقطة الإنصھار فإن الشكل المنتظم للجزیئات في المادة الصلبة تتغیر إلى شكل یكون فیه أقل انتظاماً في الحالة السائلة لذلك فإنه یحدث زیادة مفاجئة في الأنتروبي.
(2) تبدأ بعد ذلك الأنتروبي تزداد بشكل تدریجي مع ارتفاع درجة الحرارة حتى یغلي السائل. ویحدث زیادة كبیرة في حجم الأكسجین وكذلك في عدم انتظام الجزیئات ویرافق ذلك زیادة مفاجئة وكبیرة في قیمة الأنتروبي، وتستمر أنتروبي غاز الأكسجین في الزیادة ببطء مع زیادة درجة الحرارة.
– وحدات قیم الأنتروبي ھي J/K mol وليس kJ/mol نظراً لصغرها.
الأنتروبي القياسي لبعض العناصر والمركبات
– الجدول التالي الأنتروبي القیاسي لبعض العناصر والمركبات عند (25 Co) وضغط جوي واحد (1 atm)
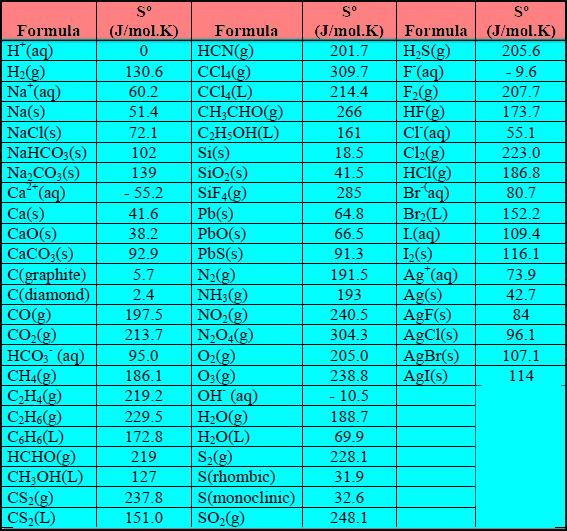
– القيم الواردة في الجدول توضح أن:
(1) أنتروبي الغازات بشكل عام أكبر من أنتروبي المواد الصلبة أو السائلة (علل) بسبب أن جزیئات المواد الغازیة أقل انتظاماً من جزیئات المواد الصلبة، وطاقتھا منتشرة على حجم أكبر أي أن طاقة جزیئات الغاز منتشرة بشكل أكبر من انتشار الطاقة المصاحبة لحركة الجزیئات في المادة الصلبة.
(2) أنتروبي المواد السائلة تقع بین أنتروبي المواد الغازیة والصلبة.
(3) أنتروبي المواد ذات الجزیئات الكبیرة عادة ما تكون أكبر من أنتروبي المواد صغیرة الجزیئات.
تغير الأنتروبي في التفاعلات الكيميائية Entropy Change in Chemical Reactions
التغیر في الأنتروبي القیاسي :(ΔSo)ھو الفرق بین مجموع قیم الأنتروبي القیاسي لجمیع المواد الناتجة ومجموع قیم الأنتروبي القیاسي لجمیع المواد المتفاعلة:
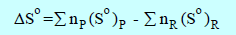
(So)p: الأنتروبي المولي القیاسي للمادة الناتجة.
:(So)Rالأنتروبي المولي القیاسي للمادة المتفاعلة.
مسائل محلولة
مثال (1): احسب التغیر في الأنتروبي القیاسي للتفاعلات التالیة:
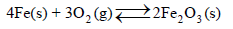
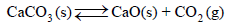
الحل:
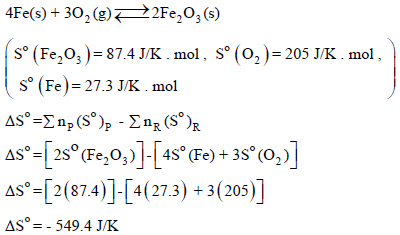
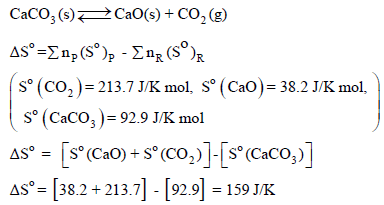
من المثال السابق نجد أن:
(1) یكون التغیر في الأنتروبي موجباً (للنظام) إذا زاد عدد المولات الغازیة خلال التفاعل:
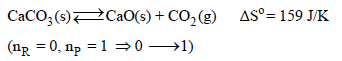
(2) یكون التغیر في الأنتروبي سالباً (للنظام) إذا نقص عدد المولات الغازیة خلال التفاعل:
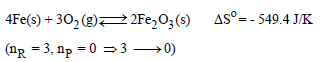
(3) إذا لم یحدث تغیر في عدد المولات الغازیة الكلي خلال التفاعل كما في التفاعل التالي:
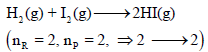
فإن التغیر في الأنتروبي یمكن أن یكون سالباً أو موجباً حسب قیم أنتروبي المواد المشتركة في التفاعل عند حسابھا
من المعادلة:
من المعادلة:
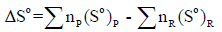
وبني التنبؤ في الفقرتین (٢ ،١) على أن أنتروبي المواد الغازیة دون استثناء أكبر بكثیر من أنتروبي المواد السائلة
والمواد الصلبة.
والمواد الصلبة.
(4) بالنسبة للتفاعلات التي یشترك فیھا مواد صلبة وسائلة فقط فیكون التنبؤ عن كیفیة تغیر الأنتروبي صعباً. وبشكل عام یمكن القول بأن الزیادة في العدد الكلي للجزیئات و/ أو الأیونات خلال التفاعل یكون مصحوباً بزیادة في أنتروبي النظام.
مثال (2): تنبأ بالتغیر في أنتروبي منظومة التفاعلات الآتیة موجباً أو سالباً؟
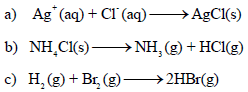
الحل:
(a) لأيونان (Ag+ , Cl–) حرية الحركة في المحلول بينما نجد أن AgCl صلب، إضافة إلى عدد الجسيمات ينقص من اليسار إلى اليمين ، إذاً (ΔS) تكون سالبة.
(b) بما أن المادة الصلبة تتحول إلى ناتجين غازيين فإن ΔS)) تكون موجبة.
(c) نفس عدد المولات في المتفاعلات والنواتج ل ذلك لا نستطیع التنبؤ بإشارة (ΔS) ولكن نعلم أن التغیر یجب أن یكون صغیراً جداً.
مثال (3): لديك قيم الأنتروبي القياسية (So) للمواد التالية:
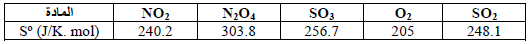
احسب (ΔSo) للتفاعلات التالية:
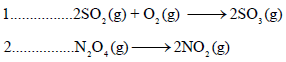
الحل:
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية