الكيمياءالكيمياء العامة
التوزيع الإلكتروني للذرة Electron Configuration of Atom

يتضح مما تقدم أن الأغلفة الرئيسية التي أشار إليها بور في
نظريته الذرية تتكون من أغلفة ثانوية متنوعة من حيث الشكل والطاقة والسعة
الإلكترونية وهذه الأغلفة بدورها تتشكل من مدارات متساوية الطاقة ذات اتجاهات
فضائية متنوعة، في ضوء هذا يتضح أن البناء الإلكتروني للذرة أو بتعبير آخر التوزيع
الإلكتروني داخل الذرة هو أعقد بكثير مما تصوره بور.
نظريته الذرية تتكون من أغلفة ثانوية متنوعة من حيث الشكل والطاقة والسعة
الإلكترونية وهذه الأغلفة بدورها تتشكل من مدارات متساوية الطاقة ذات اتجاهات
فضائية متنوعة، في ضوء هذا يتضح أن البناء الإلكتروني للذرة أو بتعبير آخر التوزيع
الإلكتروني داخل الذرة هو أعقد بكثير مما تصوره بور.
القواعد التالية تساعد على تحديد البناء الإلكتروني للذرات
المختلفة:
المختلفة:
1- ترتيب الأغلفة الثانوية
تترتب الأغلفة
الثانوية حسب ازدياد طاقتها من اليسار إلى اليمين وعلى النحو المبين أدناه:
الثانوية حسب ازدياد طاقتها من اليسار إلى اليمين وعلى النحو المبين أدناه:

على الرغم من أن الأغلفة الثانوية أعلاه لا تترب ترتيباً
رقمياً (مثال 4s يتقدم على 3d أي 3d أكثر طاقة من 4s على الرغم من أن الغلاف الرئيسي الرابع هو أبعد عن النواة من
الغلاف الرئيسي الثالث) إلا أنه يمكن تذكر تسلسل الأغلفة الثانوية وذلك من خلال
تطبيق قاعدة (n+L) والتي تنص على أن طاقة الأغلفة الثانوية تزداد كلما ازدادت قيمة (n+L)
وإذا تساوت قيمة (n+L) لغلافين ثانويين أو أكثر فأقلها طاقة ما له اقل قيمة عددية لعدد
الكم n ، حيث (n) هو عدد الكم الرئيسي ، (L) عدد الكم الثانوي .
رقمياً (مثال 4s يتقدم على 3d أي 3d أكثر طاقة من 4s على الرغم من أن الغلاف الرئيسي الرابع هو أبعد عن النواة من
الغلاف الرئيسي الثالث) إلا أنه يمكن تذكر تسلسل الأغلفة الثانوية وذلك من خلال
تطبيق قاعدة (n+L) والتي تنص على أن طاقة الأغلفة الثانوية تزداد كلما ازدادت قيمة (n+L)
وإذا تساوت قيمة (n+L) لغلافين ثانويين أو أكثر فأقلها طاقة ما له اقل قيمة عددية لعدد
الكم n ، حيث (n) هو عدد الكم الرئيسي ، (L) عدد الكم الثانوي .
مثال1: أيهما أكثر طاقة 3s أو
3P؟
3P؟
يتضح من خلال استخدام القاعدة (n+L) أن
3s
(3+صفر=3) هو اقل من 3P (3+1=4) أو بتعبير آخر الغلاف 3s يتقدم الغلاف 3p في سلسلة الأغلفة
الثانوية أعلاه.
3s
(3+صفر=3) هو اقل من 3P (3+1=4) أو بتعبير آخر الغلاف 3s يتقدم الغلاف 3p في سلسلة الأغلفة
الثانوية أعلاه.
مثال2: أيهما أكثر طاقة من بين الأغلفة (6s , 4d , 5p) حيث أن قيمة (n+L) لكل منها تساوي 6 ؟(حاول أن تثبت ذلك بنفسك).
لما كانت القيمة العددية لعدد الكم (L)
لكل من الأغلفة الثانوية (d,p,s) هي صفر،واحد ، اثنين، على
التوالي وحسب ما جاء بالجزء الثاني من قاعدة (n+L) فإن الغلاف (6s) هو أكثر هذه الأغلفة طاقة أو يمكن ترتيب هذه الأغلفة كما هو موضح
بالشكل التالي:
لكل من الأغلفة الثانوية (d,p,s) هي صفر،واحد ، اثنين، على
التوالي وحسب ما جاء بالجزء الثاني من قاعدة (n+L) فإن الغلاف (6s) هو أكثر هذه الأغلفة طاقة أو يمكن ترتيب هذه الأغلفة كما هو موضح
بالشكل التالي:

2- عدد المدارات في كل غلاف ثانوي وكيفية تمثيلها
من خلال
ما تقدم من دراستنا لأعداد الكم تبين أن عدد قيم الكم المغناطيسي ML للأغلفة الثانوية s,p,d,f هى
1,3,5,7
على التوالي ( لاحظ الجدول التالي):
ما تقدم من دراستنا لأعداد الكم تبين أن عدد قيم الكم المغناطيسي ML للأغلفة الثانوية s,p,d,f هى
1,3,5,7
على التوالي ( لاحظ الجدول التالي):
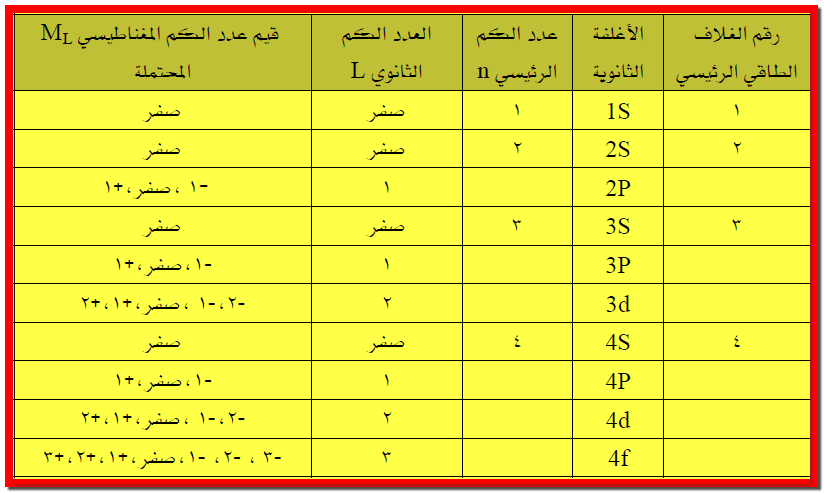
هذه الأعداد تمثل المجالات المتوفرة
للإلكترونات في كل غلاف ، ولما كان قد استخدمنا مصطلح المدار للإشارة إلى مجال
تواجد الإلكترون، إذن تحتوي الأغلفة الثانوية s,p,d,f على عدد من المدارات يساوي 1,3,5,7 على التوالي، وللسهولة يمكننا أن نمثل المدار بشكل المربع وعليه يكون
شكل الغلاف الثانوي كما هو موضح في صيغة الجدول أدناه.
للإلكترونات في كل غلاف ، ولما كان قد استخدمنا مصطلح المدار للإشارة إلى مجال
تواجد الإلكترون، إذن تحتوي الأغلفة الثانوية s,p,d,f على عدد من المدارات يساوي 1,3,5,7 على التوالي، وللسهولة يمكننا أن نمثل المدار بشكل المربع وعليه يكون
شكل الغلاف الثانوي كما هو موضح في صيغة الجدول أدناه.
3- السعة القصوى من الإلكترونات في الأغلفة
الثانوية
** السعة القصوى (Maximum Capacity)للمدار الواحد من الإلكترونات
هي اثنان. لذلك تكون السعة القصوى من الإلكترونات في الأغلفة الثانوية s,p,d,f هي 2.6.10.14 على التوالي.
هي اثنان. لذلك تكون السعة القصوى من الإلكترونات في الأغلفة الثانوية s,p,d,f هي 2.6.10.14 على التوالي.
** في حالة التعبير عن المحتوى
الإلكتروني للأغلفة الثانوية فإن عدد الإلكترونات الموجودة في كل غلاف ثانوي يكتب
في أعلى رمز الغلاف وكما هو موضح أدناه.
الإلكتروني للأغلفة الثانوية فإن عدد الإلكترونات الموجودة في كل غلاف ثانوي يكتب
في أعلى رمز الغلاف وكما هو موضح أدناه.
1s2
2s2 2p6 3s2 3p6 4s2 3d10
…………….
2s2 2p6 3s2 3p6 4s2 3d10
…………….
** مما هو جدير بالذكر أن المدار يمكن
أن يكون فارغ من الإلكترونات أو أن يحتوى على إلكترون واحد فقط لكن المدار الواحد
لا يمكن أن يحتوي على أكثر من إلكترونين.
أن يكون فارغ من الإلكترونات أو أن يحتوى على إلكترون واحد فقط لكن المدار الواحد
لا يمكن أن يحتوي على أكثر من إلكترونين.
4- التعبير عن شكل واتجاه الإلكترون
** أحياناً يعبر عن الإلكترون بشكل السهم ↑ لذا في حالة وجود إلكترون
واحد أو بتعبير آخر أول إلكترون يكتب داخل الدار (بالشكل المربع) يمثل بالشكل ↑ أي
اتجاه السهم (الإلكترون) يكون إلى الأعلى ، أما في حالة وجود العدد الأقصى من الإلكترونات
في المدار الواحد يكون اتجاه الإلكترون الثاني إلى الأسفل ↑↓
واحد أو بتعبير آخر أول إلكترون يكتب داخل الدار (بالشكل المربع) يمثل بالشكل ↑ أي
اتجاه السهم (الإلكترون) يكون إلى الأعلى ، أما في حالة وجود العدد الأقصى من الإلكترونات
في المدار الواحد يكون اتجاه الإلكترون الثاني إلى الأسفل ↑↓
** يتم التمييز بين الإلكترونين في
المدار الواحد بواسطة عدد الكم المغزلي حيث يعطى إلى السهم المتجه إلى الأعلى ↑القيمة
Ms = +½ إما الإلكترون الثاني المتجه
إلى الأسفل ↓ يعطى القيمة Ms = -½.
المدار الواحد بواسطة عدد الكم المغزلي حيث يعطى إلى السهم المتجه إلى الأعلى ↑القيمة
Ms = +½ إما الإلكترون الثاني المتجه
إلى الأسفل ↓ يعطى القيمة Ms = -½.
** لذلك يمكن القول لا يمكن لإلكترونين في ذرة واحدة أن يكون
لهما نفس قيم أعداد الكم الأربعة. وهذا ما يدعى بقاعدة باولي للاستبعاد Pauli Exclustion
Principle))
لهما نفس قيم أعداد الكم الأربعة. وهذا ما يدعى بقاعدة باولي للاستبعاد Pauli Exclustion
Principle))
5- قاعدة هوند Hund,s rule
تنص على أن الإلكترونات تتوزع بصورة منفردة في مدارات متساوية
الطاقة قبل أن تبدأ بالازدواج.
الطاقة قبل أن تبدأ بالازدواج.
أمثلة محلولة :
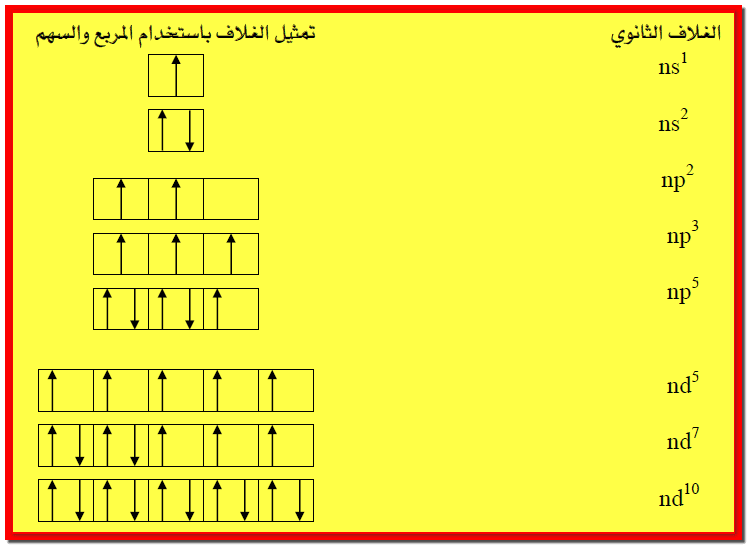
مثال1: اكتب أو مثل الأغلفة الثانوية nd10, nd7, nd5, np5,
np3, np2, ns2, ns1
باستخدام المربع والسهم للإشارة للمدار والإلكترون؟
np3, np2, ns2, ns1
باستخدام المربع والسهم للإشارة للمدار والإلكترون؟
الإجابة :
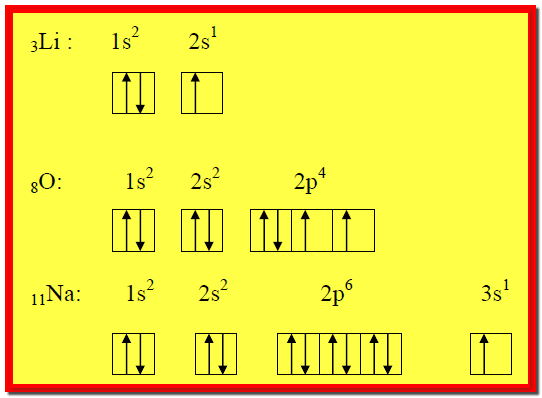
مثال2: اكتب التركيب الإلكتروني لذرات العناصر Na11, 8O, 3Li مستخدماً :
1) سلسلة الأغلفة الثانوية
2) المربع والسهم
الإجابة :
مثال3: اكتب أعداد الكم الأربعة للإلكترون الأخير في الأغلفة
الثانوية المبينة في الجدول أدناه.
الثانوية المبينة في الجدول أدناه.
ملاحظة: تحديد الإلكترون الأخير في الأغلفة الثانوية المبينة أدناه
يتطلب أولاً كتابة الترتيب الإلكتروني لهذه الأغلفة باستخدام المربع والسهم ومن ثم
تحديد الإلكترون الأخير وفقاً لقاعدة هوند.
يتطلب أولاً كتابة الترتيب الإلكتروني لهذه الأغلفة باستخدام المربع والسهم ومن ثم
تحديد الإلكترون الأخير وفقاً لقاعدة هوند.
الإجابة :
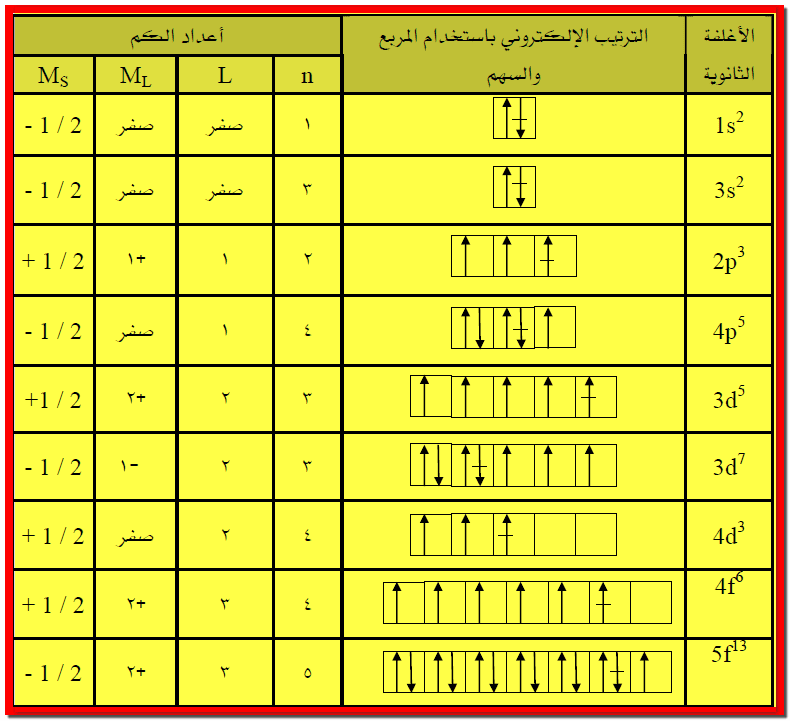
** ملاحظة : الإلكترون الأخير معلم بـ (-) في منتصف السهم
للتمييز عن باقي الإلكترونات فقط.
للتمييز عن باقي الإلكترونات فقط.
** من المثال أعلاه يمكن الاستنتاج أنه ليس هناك إلكترونين في
ذرة لهما نفس أعداد الكم الأربعة.
ذرة لهما نفس أعداد الكم الأربعة.
مثال4 : اكتب الترتيب الإلكتروني للذرات والأيونات التالية:
15P3-, 15P3+ , 15P
, 8O2- , 8O , 7N4+ , 7N3-
, 7N , 1H+ , 1H
, 8O2- , 8O , 7N4+ , 7N3-
, 7N , 1H+ , 1H
وذلك باستخدام : (أ) سلسة الأغلفة الثانوية ، (ب)
المربع والسهم.
المربع والسهم.
الإجابة:
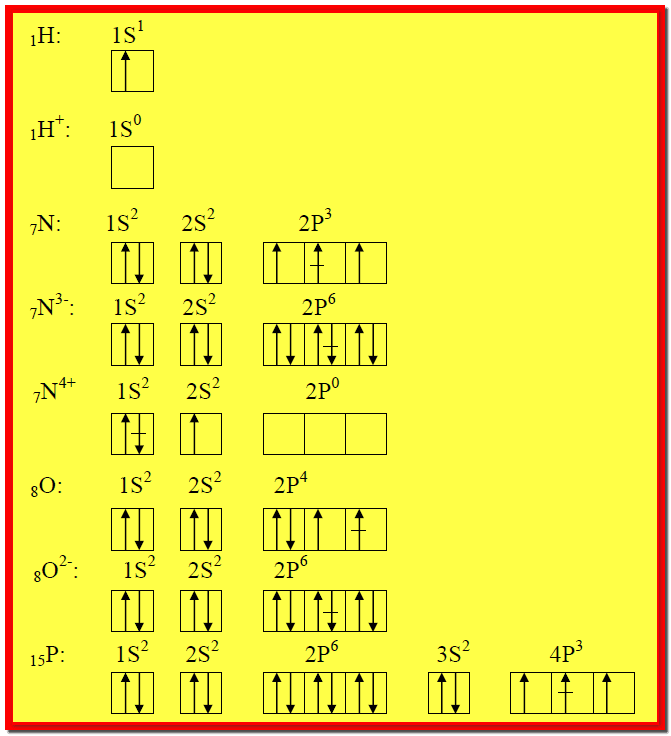
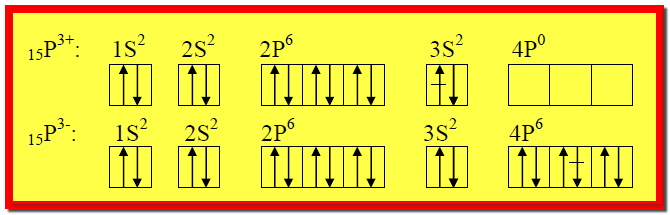
ملاحظات :
** لاحظ بشكل دقيق الفرق (الزيادة أو
النقصان ) بين الترتيب الإلكتروني للذرة وأيونها أو أيوناتها.
النقصان ) بين الترتيب الإلكتروني للذرة وأيونها أو أيوناتها.
** العلامة (-) في منتصف السهم تشير إلى الإلكترون ما قبل الأخير
والذي نحتاجه للإجابة على الفرع (ب) من هذا المثال على خلاف هذا ليس هناك حاجة إلى
وضع العلامة (-)
والذي نحتاجه للإجابة على الفرع (ب) من هذا المثال على خلاف هذا ليس هناك حاجة إلى
وضع العلامة (-)
مثال5: عين أعداد الكم الأربعة
للإلكترون ما قبل الأخير في الذرات والأيونات في المثال السابق (ماعدا الهيدروجين
وأيونه)؟
للإلكترون ما قبل الأخير في الذرات والأيونات في المثال السابق (ماعدا الهيدروجين
وأيونه)؟
الأجابة:
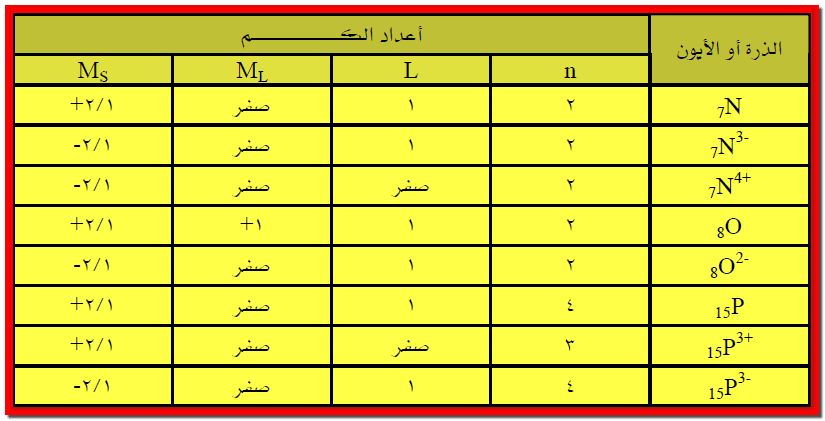
الترتيب الثماني المستقر Stable Octet Configuration
لذرات عناصر الغازات المثالية (ماعدا ذرة عنصر الهيليوم 4He2) وكذلك أيونات بعض العناصر
الأخرى بالترتيب الإلكتروني الخارجي ns2
np6 .
** يوصف هذا الترتيب بالترتيب
الثماني المستقر وذلك بسبب ما هو معروف من استقرارية كيميائية للذرات والأيونات
والتي ينتهي ترتيبها الإلكتروني بـ ns2 np6 وكذلك لوجود ثمانية إلكترونات فيه.
الثماني المستقر وذلك بسبب ما هو معروف من استقرارية كيميائية للذرات والأيونات
والتي ينتهي ترتيبها الإلكتروني بـ ns2 np6 وكذلك لوجود ثمانية إلكترونات فيه.

** قد يفسر هذا الترتيب وجود ذرات العناصر
المثالية في الطبيعة على شكل ذرات مفردة وكذلك ارتفاع طاقة تأينها بالمقارنة مع
طاقات التأين الأولى لذرات العناصر التي تقع معها في نفس الدورة.
المثالية في الطبيعة على شكل ذرات مفردة وكذلك ارتفاع طاقة تأينها بالمقارنة مع
طاقات التأين الأولى لذرات العناصر التي تقع معها في نفس الدورة.
المراجع
– إنتاج كيميائي – الكيمياء العامة – 180 كيم، الإدارة العامة لتصميم وتطوير المناهج- المملكة العربية السعودية.