الكيمياء العامة
مفهوم الذرة – نظرة تاريخية Concept of Atom- Historical view

(1) الفلاسفة
اليونانيين Greek philosophers – 400
سنة قبل الميلاد
** أن الكلمة الإنجليزية (Atom)
والذي تدعى باللغة العربية الذرة يرجع أصلها إلى اللغة اليونانية وهي تعني الشئ
الذي لا يقبل الانقسام (Indivisible)
** أقترح الفلاسفة اليونانيين منذ حوالي 400 سنة قبل الميلاد
تعريفاً للذرة والذي ينص على أن الذرة جسيم صغير جداً لا يمكن رؤيته مستقلاً بذاته،
غير قابل للانقسام، يشكل وحدة بناء المادة ، ومما يجدر ذكره أن هذا التعريف كان
نتاج تأمل وتصور فلسفي فقط أو بمعنى آخر لم يستند إلى الأدلة والملاحظات
التجريبية.
والذي تدعى باللغة العربية الذرة يرجع أصلها إلى اللغة اليونانية وهي تعني الشئ
الذي لا يقبل الانقسام (Indivisible)
** أقترح الفلاسفة اليونانيين منذ حوالي 400 سنة قبل الميلاد
تعريفاً للذرة والذي ينص على أن الذرة جسيم صغير جداً لا يمكن رؤيته مستقلاً بذاته،
غير قابل للانقسام، يشكل وحدة بناء المادة ، ومما يجدر ذكره أن هذا التعريف كان
نتاج تأمل وتصور فلسفي فقط أو بمعنى آخر لم يستند إلى الأدلة والملاحظات
التجريبية.
(2) جون دالتون John
Dalton–1805 – 1808
** بين عام 1805 – 1808م نشر الإنجليزي
جون دالتون أول الفرضيات الحديثة التي تصف وجود وطبيعة الذرة.
** استند دالتون على
الملاحظات والتجارب العلمية التي كانت معروفة آنذاك في صياغة فرضيات نظرية دالتون
الذرية.
** تمتاز هذة الفرضيات بقرب مضمونها من فرضيات النظرية الذرية الحديثة (Modern Atomic Theory)
لهذا السبب يعتبر العالم الإنجليزي جون دالتون أباً أو مؤسساً للنظرية الذرية
الحديثة.
** فيما يلي ملخصاً لأهم فرضيات دالتون:
جون دالتون أول الفرضيات الحديثة التي تصف وجود وطبيعة الذرة.
** استند دالتون على
الملاحظات والتجارب العلمية التي كانت معروفة آنذاك في صياغة فرضيات نظرية دالتون
الذرية.
** تمتاز هذة الفرضيات بقرب مضمونها من فرضيات النظرية الذرية الحديثة (Modern Atomic Theory)
لهذا السبب يعتبر العالم الإنجليزي جون دالتون أباً أو مؤسساً للنظرية الذرية
الحديثة.
** فيما يلي ملخصاً لأهم فرضيات دالتون:
(1) جميع المواد تتكون من جسيمات
صغيرة جداً – غير قابلة للانقسام – تدعى الذرات.
صغيرة جداً – غير قابلة للانقسام – تدعى الذرات.
(2) تمتاز ذرات العنصر الواحد بخواص
فيزيائية وكيميائية متطابقة وتختلف عن خواص ذرات العناصر الأخرى.
فيزيائية وكيميائية متطابقة وتختلف عن خواص ذرات العناصر الأخرى.
(3) ذرات العناصر المختلفة يمكنها أن
تتحد بإعداد صحيحة بسيطة لتكوين مركبات Compounds
علماً أن ذرات العناصر المختلفة تفقد معظم خواصها (ماعدا الوزن الذري) عند تكوينها
للمركبات.
تتحد بإعداد صحيحة بسيطة لتكوين مركبات Compounds
علماً أن ذرات العناصر المختلفة تفقد معظم خواصها (ماعدا الوزن الذري) عند تكوينها
للمركبات.
(3) جوزيف جون طومسون J.J.Thomson – 1897
** في عام 1897م قام العالم الإنجليزي
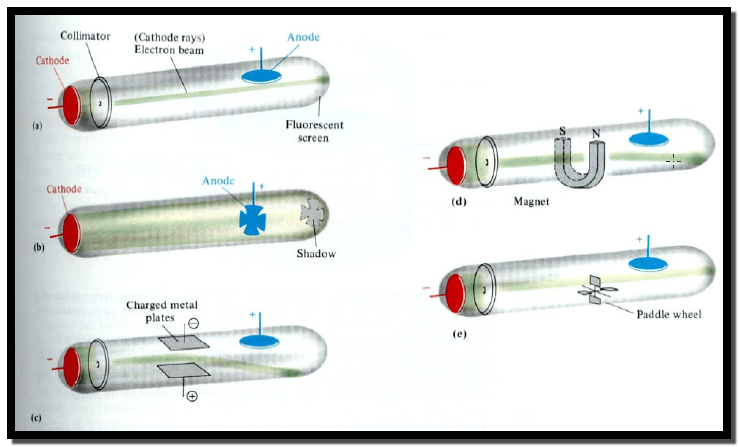
جي جي طومسون بتجربة مستخدماً فيها أنبوباً زجاجياً مفرغاً من الهواء ومتصلاً بملف
(Coil) يدعى الملف الشراري أو
الوميضي (Spark Coil) كما هو موضح بالشكل التالي :
جي جي طومسون بتجربة مستخدماً فيها أنبوباً زجاجياً مفرغاً من الهواء ومتصلاً بملف
(Coil) يدعى الملف الشراري أو
الوميضي (Spark Coil) كما هو موضح بالشكل التالي :
 |
| تجربة إكتشاف الألكترون |
** لاحظ طومسون انبعاث شعاعاً من الضوء (A beam of Light)
عند تسليط فرق جهد مناسب على طرفي الأنبوب المفرغ (Evacuated
tube) سمي هذا الشعاع الضوئي بالشعاع
الكاثودي (Cathode Rays) كما لوحظ انحراف (Deflection) الشعاع الكاثودي عند مروره في كل من المجال الكهربائي (Electrical Field)
والمجال المغناطيسي (Magnetic
Field).
** في ضوء هذه التجربة وما رافقها
من ملاحظات توصل طومسون إلى الاستنتاج التالي:
عند تسليط فرق جهد مناسب على طرفي الأنبوب المفرغ (Evacuated
tube) سمي هذا الشعاع الضوئي بالشعاع
الكاثودي (Cathode Rays) كما لوحظ انحراف (Deflection) الشعاع الكاثودي عند مروره في كل من المجال الكهربائي (Electrical Field)
والمجال المغناطيسي (Magnetic
Field).
** في ضوء هذه التجربة وما رافقها
من ملاحظات توصل طومسون إلى الاستنتاج التالي:
(1) أن الشعاع الكاثودي يتكون من جسيمات
(Particles) متناهية في الصغر تحمل شحنة كهربائية سالبة سماها بالإلكترونات،
لذلك يعتبر طومسون مكتشف الإلكترون والذي هو أحد مكونات الذرة.
(Particles) متناهية في الصغر تحمل شحنة كهربائية سالبة سماها بالإلكترونات،
لذلك يعتبر طومسون مكتشف الإلكترون والذي هو أحد مكونات الذرة.
(2) نجح طومسون في إيجاد أو حساب نسبة
الشحنة الكهربائية للإلكترون إلى كتلته (e/m)
الشحنة الكهربائية للإلكترون إلى كتلته (e/m)
** بسبب هذه الإنجازات العلمية وفي عام 1906 منح العالم طومسون جائزة
نوبل (Nobel prize)
(4) روبرت مليكان Robert
Milliken – 1909
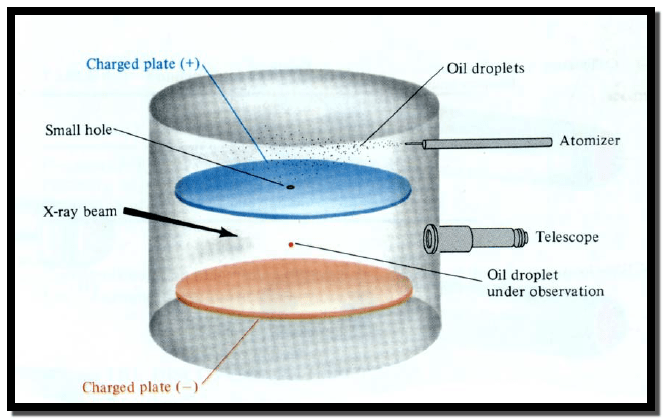
** في عام 1909م تمكن العالم الأمريكي روبرت مليكان من قياس كمية
الشحنة الكهربائية الموجودة على الإلكترون وذلك باستخدام الجهاز المبين مخططه
أدناه :
الشحنة الكهربائية الموجودة على الإلكترون وذلك باستخدام الجهاز المبين مخططه
أدناه :
 |
| مخطط جهاز قياس كمية شحنة الإلكترون |
** تتضمن تجربة مليكان دفع رذاذ زيت إلى داخل حجرة أو تجويف (Chamber)
حيث إن بعض قطرات الزيت وبشكل عشوائي فقدت إلكترون والبعض الآخر اكتسب إلكترون مما
أدي إل تكوين قطرات تحمل شحنة سالبة وأخرى تحمل شحنة موجبة على التوالي، ومن خلال
ضبط أو تعديل للمجال الكهربائي الموجود بين الصفيحة الموجبة والصفيحة السالبة يمكن
التحكم بالحركة العلوية للقطرات سالبة الشحنة، حيث يتم متابعة قطرة الزيت سالبة
الشحنة بواسطة ناظور مناسب، ومعرفة معدل سرعة القطرة نحو الأعلى، وشدة المجال
الكهربائي وكذلك كتلة أو وزن القطرة.
حيث إن بعض قطرات الزيت وبشكل عشوائي فقدت إلكترون والبعض الآخر اكتسب إلكترون مما
أدي إل تكوين قطرات تحمل شحنة سالبة وأخرى تحمل شحنة موجبة على التوالي، ومن خلال
ضبط أو تعديل للمجال الكهربائي الموجود بين الصفيحة الموجبة والصفيحة السالبة يمكن
التحكم بالحركة العلوية للقطرات سالبة الشحنة، حيث يتم متابعة قطرة الزيت سالبة
الشحنة بواسطة ناظور مناسب، ومعرفة معدل سرعة القطرة نحو الأعلى، وشدة المجال
الكهربائي وكذلك كتلة أو وزن القطرة.
** قادت هذه التجربة مليكان لحساب كمية
الشحنة السالبة على قطرة الزيت والتي تساوي كمية الشحنة السالبة على الإلكترون
الواحد، وبفضل الجمع بين نتائج مليكان ونتائج تجارب طومسون ، تمكن مليكان من حساب
كتلة الإلكترون والتي تساوى 9.11 × 10-28 جم.
الشحنة السالبة على قطرة الزيت والتي تساوي كمية الشحنة السالبة على الإلكترون
الواحد، وبفضل الجمع بين نتائج مليكان ونتائج تجارب طومسون ، تمكن مليكان من حساب
كتلة الإلكترون والتي تساوى 9.11 × 10-28 جم.
(5) ايرنست رزرفورد Ernest
Rutherford – 1911
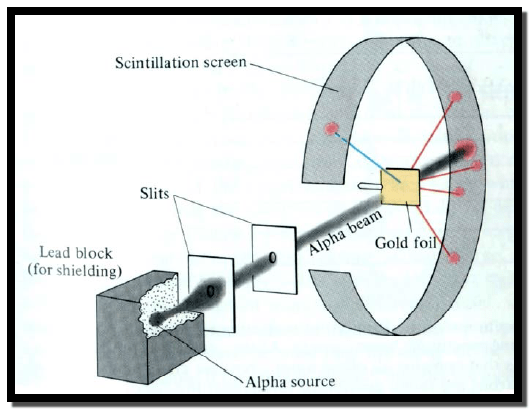
** في عام 1911م قام العالم الإنجليزي ايرنست رذرفورد بتجربته
الشهيرة المسماة بتجربة رقيقة الذهب (Gold
Foil Experiment) والتي كانت
لها أثر متميز في صياغة النظرية الذرية الحديثة.
الشهيرة المسماة بتجربة رقيقة الذهب (Gold
Foil Experiment) والتي كانت
لها أثر متميز في صياغة النظرية الذرية الحديثة.
** في هذه التجربة أسقط رذرفورد أشعة
ألفا (أشعة ألفا عبارة عن تيار من نويات عنصر الهليوم (He على رقيقة الذهب.
ألفا (أشعة ألفا عبارة عن تيار من نويات عنصر الهليوم (He على رقيقة الذهب.
 |
| تجربة رذرفورد |
** لاحظ رذرفورد ما يلي:
(1) العدد الكبير من جسيمات أشعة ألفا
(Alpha particles) مر بمسار مستقيم من خلال الرقيقة.
(Alpha particles) مر بمسار مستقيم من خلال الرقيقة.
(2) عدد قليل يقدر بــــ 1/8000 من
جسيمات ألفا المنحرفة عن المسار المستقيم ارتدت وبشكل مستقيم باتجاه مصدر الأشعة.
جسيمات ألفا المنحرفة عن المسار المستقيم ارتدت وبشكل مستقيم باتجاه مصدر الأشعة.
** لقد تم تفسير نتائج أو ملاحظات
التجربة كالتالي:
التجربة كالتالي:
(1) انحراف العدد القليل من جسيمات
أشعة ألفا موجبة الشحنة يشير إلى مرورها بالقرب من جسيم ذري متمركز يحمل شحنة
موجبة، أما الارتداد المستقيم لبعض الأشعة المنحرفة فهذا ناتج عن اصطدامها بالجسيم
الذري الموجب.
أشعة ألفا موجبة الشحنة يشير إلى مرورها بالقرب من جسيم ذري متمركز يحمل شحنة
موجبة، أما الارتداد المستقيم لبعض الأشعة المنحرفة فهذا ناتج عن اصطدامها بالجسيم
الذري الموجب.
(2) مرور القسم الأكبر من أشعة ألفا
يعني وجود مساحات فارغة (Empty
Spaces) بين الجسيم الذري الذي يحمل الشحنة
الموجبة والإلكترونات ذات الشحنة السالبة والتي تحدد حجم الذرة.
** التجارب اللاحقة التي قام بها
رذرفورد كشفت على أن الجسيم الكثيف ذات الشحنة الموجبة (النوية) يحتوي على جسيمات
صغيرة تحمل شحنة موجبة تدعى البروتونات(Protons)
سرعان ما أدرك رذرفورد أن البروتونات هي ليست
المكون الوحيد للنويه وذلك من خلال الفرق بين مجموع كتل هذه البروتونات وكتلة
النوية، لهذا السبب توقع رذرفورد وجود جسيمات أخري متعادلة الشحنة في النوية.
رذرفورد كشفت على أن الجسيم الكثيف ذات الشحنة الموجبة (النوية) يحتوي على جسيمات
صغيرة تحمل شحنة موجبة تدعى البروتونات(Protons)
سرعان ما أدرك رذرفورد أن البروتونات هي ليست
المكون الوحيد للنويه وذلك من خلال الفرق بين مجموع كتل هذه البروتونات وكتلة
النوية، لهذا السبب توقع رذرفورد وجود جسيمات أخري متعادلة الشحنة في النوية.
(6) جيمس تشادويك James
Chadwick – 1932
** في
عام 1932م تمكن العالم الإنجليزي جيمس تشادويك من اكتشاف الجسيمات النووية
المتعادلة والمسماة بالنيترونات (Neutrons).
عام 1932م تمكن العالم الإنجليزي جيمس تشادويك من اكتشاف الجسيمات النووية
المتعادلة والمسماة بالنيترونات (Neutrons).
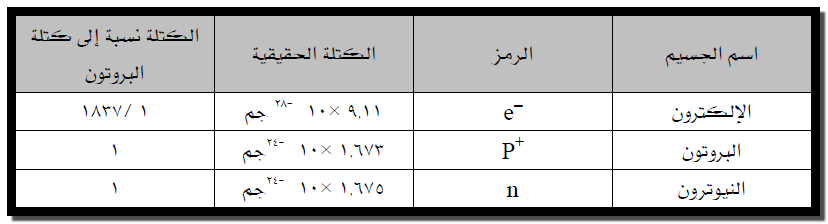
** على الرغم من تجاوز عدد الجسيمات الموجودة في الذرة والمعروفة
لدينا فى الوقت الحاضر 90 جسيم
إلا أن الجسيمات المسماة بالإلكترونات والبروتونات والنيترونات هي من أكثر هذه
الجسيمات استخداماً فى كتب الكيمياء. ويوضح الجدول التالي بعض ثوابت مكونات الذرة
الرئيسية:
لدينا فى الوقت الحاضر 90 جسيم
إلا أن الجسيمات المسماة بالإلكترونات والبروتونات والنيترونات هي من أكثر هذه
الجسيمات استخداماً فى كتب الكيمياء. ويوضح الجدول التالي بعض ثوابت مكونات الذرة
الرئيسية:
(7) نيلز بور Neils
Bohr – 1913
** فى عام 1913 تقدم العالم الفيزيائي الدنماركي نيلز بور بنموذج
يلخص تركيب الذرة والذي يمكن إيجازه بالنقاط الآتية:
يلخص تركيب الذرة والذي يمكن إيجازه بالنقاط الآتية:
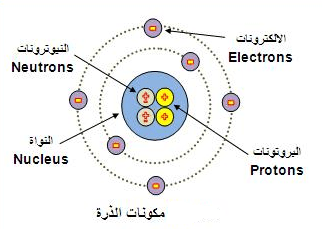
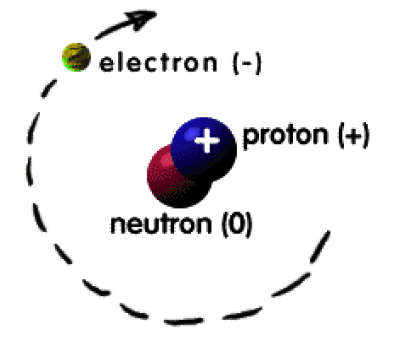
(1) للذرة نوية موجبة
الشحنة ذات كثافة عالية.
الشحنة ذات كثافة عالية.
(2) إلكترونات سالبة الشحنة توجد في مدارات دائرية محددة حول
النوية كما تسمى هذا المدارات (Orbits) بالمستويات الطاقية (Energy
Levels) أو بالأغلفة (Shells).
النوية كما تسمى هذا المدارات (Orbits) بالمستويات الطاقية (Energy
Levels) أو بالأغلفة (Shells).
(3) تترتب هذه المدارات أو مستويات الطاقة حول النوية بشكل
تشترك فيه جميعها بمركز واحد. حيث استخدمت الحروف P,O,N,M,L,K للإشارة إلى هذه المستويات أو
المدارات، المستوى K هو
أقرب المستويات إلى النوية، في الوقت الحاضر تستخدم الأرقام 1,2,3,4,5,6,….. وهكذا
لإشارة إلى هذه المدارات، علماً بأن المدار 1 هو أقرب المدارات إلى
النوية.
تشترك فيه جميعها بمركز واحد. حيث استخدمت الحروف P,O,N,M,L,K للإشارة إلى هذه المستويات أو
المدارات، المستوى K هو
أقرب المستويات إلى النوية، في الوقت الحاضر تستخدم الأرقام 1,2,3,4,5,6,….. وهكذا
لإشارة إلى هذه المدارات، علماً بأن المدار 1 هو أقرب المدارات إلى
النوية.
(4) تزداد طاقة هذه المستويات الطاقية كلما ابتعدنا عن النوية
لذلك يمكن ترتيب هذه المستويات الطاقية حسب ازدياد طاقتها بالشكل المبين:
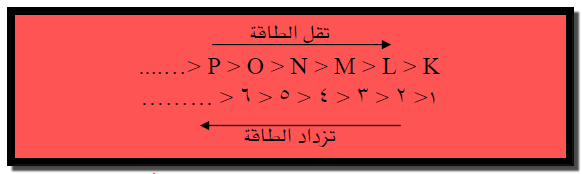
حيث من الواضح أن المستوى K أو 1 القريب من النوية هو أقل المستويات
طاقة.
طاقة.
(5) يحتاج الإلكترون إلى طاقة من أجل أن ينتقل من مستوى طاقى
أقل إلى مستوى طاقي أعلى.
(6) يتسع المستوى الطاقي المعين إلى عدد أقصى من الإلكترونات
يساوي 2n2 حيث n تمثل رقم المستوى الطاقي أو الغلاف
الرئيسي. مثال: العدد الأقصى من الإلكترونات التي يمكن أن تتواجد فى
المدار الثالث = 2 × 32 = 18 إلكترون.
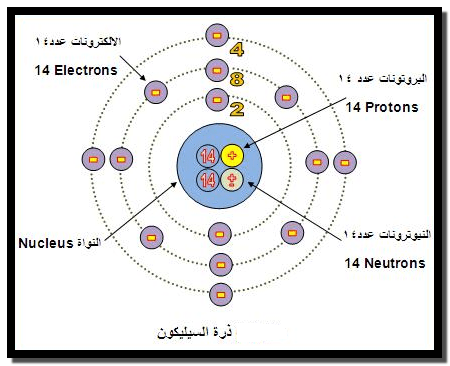
** يتضح من كل ما تقدم أعلاه أن رسم مخطط يبين التركيب الذري
لذرة عنصر ما وحسب تصور العالم بور يعتبر معرفة عدد الإلكترونات والبروتونات
والنيترونات الموجودة في تلك الذرة. كالمثال التالي لذرة السيليكون:
لذرة عنصر ما وحسب تصور العالم بور يعتبر معرفة عدد الإلكترونات والبروتونات
والنيترونات الموجودة في تلك الذرة. كالمثال التالي لذرة السيليكون:
(8) هنري موزلي Henry
Moseley – 1913
** الفيزيائي الإنجليزي هنري موزلي هو أول من عين الأعداد الذرية
لعدد من العناصر باستخدام أشعة أكس (X-rays)
لعدد من العناصر باستخدام أشعة أكس (X-rays)
في عام 1913 وجد موزلي أنه باستخدام طيف أشعة أكس الناتج عن التشتت (Diffraction) في البلورات ، وجد علاقةً بين الطول الموجي و العدد الذري للمواد و أصبحت تلك العلاقة تعرف فيما بعد بقانون موزلي.
** قبيل هذا الاكتشاف
كان الاعتقاد السائد أن الأعداد الذرية هي أعداد اختيارية ناتجة عن تسلسل الأوزان الجزيئية للمواد والتي كانت تعدل عند
اللزوم (كما فعل ديميترى مندليف) لوضع مادة ما في مكانها الصحيح في الجدول الدوري. وجد موزلي أن مندلييف استبدل عدة عناصر في الجدول الدوري . وعلى سبيل المثال أعطى مندليف العنصرين الكوبلت و النيكل العدد الذري 27 ، 28 على
التوالي على أساس خواصهما الفيزيائية والكيميائية . ولكن موزلي باستخدام مطياف الأشعة
السينية وجد أن الكوبلت أثقل قليلا من النيكل ، وبهذا استبدل وضعي النيكل والكوبالت
في الجدول الدوري.
** باكتشافه هذا فقد برهن موزلي على أن الأعداد الذرية ليست
اختيارية بل هي كميات يمكن قياسها مخبرياً.
كان الاعتقاد السائد أن الأعداد الذرية هي أعداد اختيارية ناتجة عن تسلسل الأوزان الجزيئية للمواد والتي كانت تعدل عند
اللزوم (كما فعل ديميترى مندليف) لوضع مادة ما في مكانها الصحيح في الجدول الدوري. وجد موزلي أن مندلييف استبدل عدة عناصر في الجدول الدوري . وعلى سبيل المثال أعطى مندليف العنصرين الكوبلت و النيكل العدد الذري 27 ، 28 على
التوالي على أساس خواصهما الفيزيائية والكيميائية . ولكن موزلي باستخدام مطياف الأشعة
السينية وجد أن الكوبلت أثقل قليلا من النيكل ، وبهذا استبدل وضعي النيكل والكوبالت
في الجدول الدوري.
** باكتشافه هذا فقد برهن موزلي على أن الأعداد الذرية ليست
اختيارية بل هي كميات يمكن قياسها مخبرياً.
المراجع :
– إنتاج كيميائي – الكيمياء العامة- 180 كيم، الإدارة
العامة لتصميم وتطوير المناهج- المملكة العربية السعودية
العامة لتصميم وتطوير المناهج- المملكة العربية السعودية





