الكيمياءالكيمياء العامة
الميل الإلكتروني (الألفة الإلكترونية ) Electron Affinity

إن الذرة عندما تفقد إلكتروناً و هي في حالتها الغازية فإنها
تتحول إلى آيون موجب و تكون هذه
العملية مصحوبة بامتصاص طاقة ، أما عندما تكتسب الذرة إلكتروناً وهي في الحالة
الغازية فإنها تتحول إلى أيون سالب و تنطلق نتيجة لذلك طاقة.
تتحول إلى آيون موجب و تكون هذه
العملية مصحوبة بامتصاص طاقة ، أما عندما تكتسب الذرة إلكتروناً وهي في الحالة
الغازية فإنها تتحول إلى أيون سالب و تنطلق نتيجة لذلك طاقة.
تعريف الميل الإلكتروني (الألفة الإلكترونية)
مقدار الطاقة المنطلقة من الذرة المفردة وهي في حالتها الغازية
عندما تكتسب إلكتروناً مكونةً أيوناً سالباً “
عندما تكتسب إلكتروناً مكونةً أيوناً سالباً “
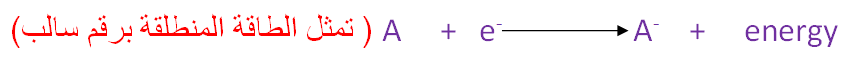
بعض الذرات تجبر على إكتساب إلكترون بإعطائها طاقة فتكون أيون
سالب . ولكنه فى هذه الحالة تكون غير مستقرة.

ملاحظات
هامة
(1)
الذرة تكتسب إلكترون أو أكثر حتى يصبح عدد
الإلكترونات فى مستوى الطاقة الخارجى ثمانية إلكترونات . وتكون الذرة أكثر
إستقرارا.
الذرة تكتسب إلكترون أو أكثر حتى يصبح عدد
الإلكترونات فى مستوى الطاقة الخارجى ثمانية إلكترونات . وتكون الذرة أكثر
إستقرارا.
(2)
يقاس الميل الألكترونى بوحدة الطاقة ( إلكترون فولت eV).
يقاس الميل الألكترونى بوحدة الطاقة ( إلكترون فولت eV).
(3)
العملية العكسية للميل الألكتروني هي طاقة التأين ( جهد التأين ).
العملية العكسية للميل الألكتروني هي طاقة التأين ( جهد التأين ).
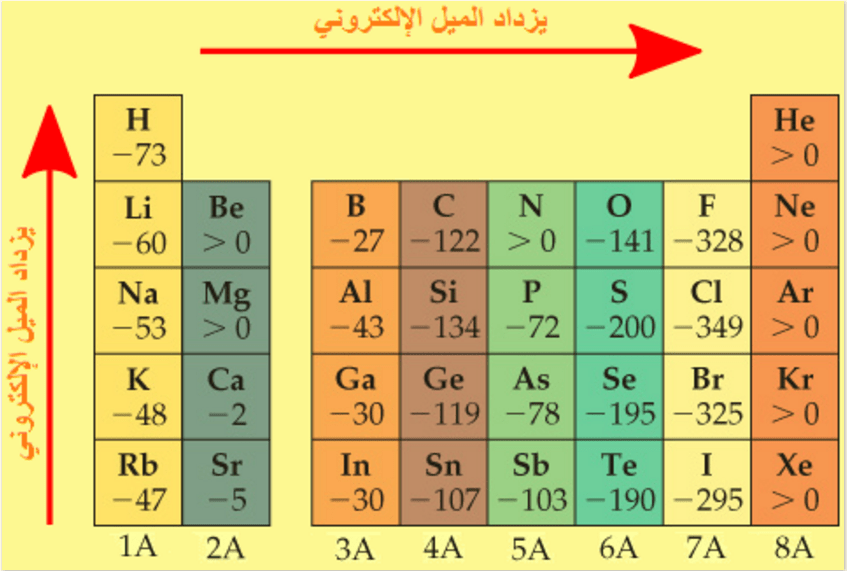
(4) الكلور له أعلى
ميل الكتروني بين العناصر حيث يعتبر الكلور أقوى العناصر التي يمكن أن تقوم بالهجوم
على الإلكترونات واقتناصها بينما الرادون أضعفها.
ميل الكتروني بين العناصر حيث يعتبر الكلور أقوى العناصر التي يمكن أن تقوم بالهجوم
على الإلكترونات واقتناصها بينما الرادون أضعفها.
(5)
الميل الألكتروني لللافلزات أكبر من الفلزات. كما أن الغازات النبيلة تعتبر استثناء حيث تكون
قيمة الميل الألكتروني لها موجبة.
الميل الألكتروني لللافلزات أكبر من الفلزات. كما أن الغازات النبيلة تعتبر استثناء حيث تكون
قيمة الميل الألكتروني لها موجبة.
(6)
الميل الإلكتروني للغازات النبيلة قليل جدا ويكون موجب لأن مستوى الطاقة الخارجي
لها مكتمل . وإذا أرغمت على إكتساب إلكترون يكون ذلك بامتصاصها كمية طاقة كبيرة .
ولكن لا تلبث أن تفقد هذا الإلكترون لأنها تكون غير مستقرة فى هذه الحالة.
الميل الإلكتروني للغازات النبيلة قليل جدا ويكون موجب لأن مستوى الطاقة الخارجي
لها مكتمل . وإذا أرغمت على إكتساب إلكترون يكون ذلك بامتصاصها كمية طاقة كبيرة .
ولكن لا تلبث أن تفقد هذا الإلكترون لأنها تكون غير مستقرة فى هذه الحالة.
(7) الميل الألكترونى لا يكون للعناصر وحسب بل يمتد ليشمل الجزئيات أيضا فالميل
الألكتروني للبنزين موجب والميل الالكتروني للهيكسا سيانو بنزين يفوق الفلور.
الألكتروني للبنزين موجب والميل الالكتروني للهيكسا سيانو بنزين يفوق الفلور.
(8)
الميل الإلكتروني يساوى -50)) للانثانيدات . ويساوى صفر
للأكتينيدات.
الميل الإلكتروني يساوى -50)) للانثانيدات . ويساوى صفر
للأكتينيدات.
قيم الميل الألكترونى
أ – متى تكون قيم الميل الالكتروني صغيرة ؟
** تكون قيمة الميل الالكتروني
أصغر مايمكن عندما تكون العناصر مستقره وإذا دخل عليها أي إلكترون يخرجها من هذا الاستقرار فمثلا” العناصر الخاملة
أو النبيلة يكون الميل الألكترونى بها أقل مايمكن نظرا” لنظامها الألكترونى
المستقر.
** كذلك كلا” من البريليوم والماغنسيوم والفوسفور
والنيتروجين يقل الميل الألكترونى لهما عما هو متوقع أن يكون عليه ، حيث يكون المستوى الفرعي ممتلئ في كلا” من الماغنسيوم
والبريليوم ونصف ممتلئ في النيتروجين والفوسفور
** ويمكننا تلخيص ذلك كالتالي:
(1) إذا كان العنصر مستقر ( مستوى الطاقة الأساسي
الأخير مكتمل كما في العناصر الخاملة ) فأنها تكون أقل ميل ألكترونى.
(2) إذا كان مستوى
الطاقة الفرعي الأخير ممتلئ أو نصف ممتلئ فتميل الذرة إلى الاستقرار نسبياً فيكون
الميل الألكترونى أقل من المتوقع بالنسبة لمكانه في الدورة .
أصغر مايمكن عندما تكون العناصر مستقره وإذا دخل عليها أي إلكترون يخرجها من هذا الاستقرار فمثلا” العناصر الخاملة
أو النبيلة يكون الميل الألكترونى بها أقل مايمكن نظرا” لنظامها الألكترونى
المستقر.
** كذلك كلا” من البريليوم والماغنسيوم والفوسفور
والنيتروجين يقل الميل الألكترونى لهما عما هو متوقع أن يكون عليه ، حيث يكون المستوى الفرعي ممتلئ في كلا” من الماغنسيوم
والبريليوم ونصف ممتلئ في النيتروجين والفوسفور
** ويمكننا تلخيص ذلك كالتالي:
(1) إذا كان العنصر مستقر ( مستوى الطاقة الأساسي
الأخير مكتمل كما في العناصر الخاملة ) فأنها تكون أقل ميل ألكترونى.
(2) إذا كان مستوى
الطاقة الفرعي الأخير ممتلئ أو نصف ممتلئ فتميل الذرة إلى الاستقرار نسبياً فيكون
الميل الألكترونى أقل من المتوقع بالنسبة لمكانه في الدورة .
ملحوظة هامة: نقص قوة جذب النواة للإلكترونات مما يصعب من
اكتسابها للإلكترونات وبذلك
تتميز الفلزات ذات لأحجام الكبيرة بصغر ميلها الإلكتروني
اكتسابها للإلكترونات وبذلك
تتميز الفلزات ذات لأحجام الكبيرة بصغر ميلها الإلكتروني
ب – متى تكون قيم الميل الالكتروني كبيرة ؟
تكون قيم الميل الالكتروني
كبيرة عندما يعمل الإلكترون المكتسب على ملء
مستوى الطاقة الأخير أو يجعل مستوى الطاقة الفرعي ممتلئ أو نصف ممتلئ .
كبيرة عندما يعمل الإلكترون المكتسب على ملء
مستوى الطاقة الأخير أو يجعل مستوى الطاقة الفرعي ممتلئ أو نصف ممتلئ .
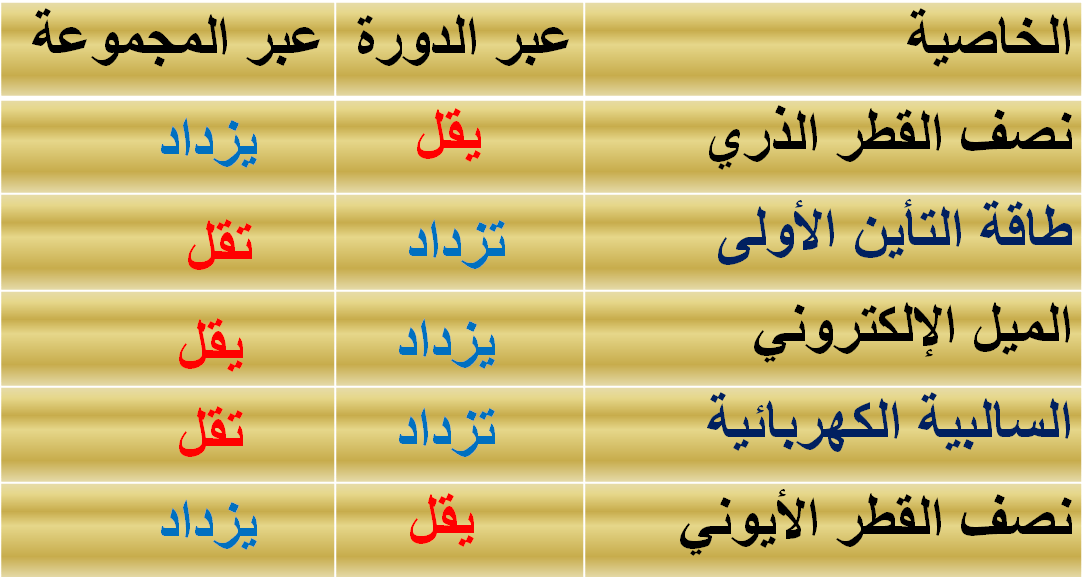
تدرج
الميل الالكتروني لعناصر الجدول الدوري
في الدورات الأفقية
** يزداد الميل الإلكتروني بزيادة العدد الذري من اليسار إلى
اليمين.
** السبب في ذلك يعود
إلى صغر أنصاف الأقطار كلما اتجهنا من اليسار إلى اليمين ، مما يسهل للنواة جذب
الإلكترون الجديد
. ويشذ
عن ذلك – البريليوم لأن مستوياته الفرعية ممتلئة فهو مستقر والنيتروجين لأن
مستوياته الفرعية نصف ممتلئة فهو مستقر. -الغازات الخاملة لها ميل إلكتروني منخفض
بسبب ملء مستويات الطاقة.
في المجموعات الرأسية
** يقل الميل الإلكتروني في المجموعة الواحدة
بزيادة العدد الذري من أعلى إلى أسفل.
بزيادة العدد الذري من أعلى إلى أسفل.
** السبب يعود إلى
التزايد في نصف قطر الذرة كلما اتجهنا من أعلى إلى أسفل ، مما يجعل الإلكترونات في
المستوى الأخير بعيدة نسبياً عن مركز الجذب في النواة ، و لذلك تضعف قدرة الذرة
على جذب الإلكترون الجديد ويشذ عن ذلك الفلور والكلور – فالفلور له ميل
إلكتروني اقل من الكلور بسبب صغر نصف قطره لذلك فإن إضافة إلكترون جديد يعاني من
تنافر كبير.
التزايد في نصف قطر الذرة كلما اتجهنا من أعلى إلى أسفل ، مما يجعل الإلكترونات في
المستوى الأخير بعيدة نسبياً عن مركز الجذب في النواة ، و لذلك تضعف قدرة الذرة
على جذب الإلكترون الجديد ويشذ عن ذلك الفلور والكلور – فالفلور له ميل
إلكتروني اقل من الكلور بسبب صغر نصف قطره لذلك فإن إضافة إلكترون جديد يعاني من
تنافر كبير.
مقارنة توضح تدرج الخواص للعناصر فى الجدول الدورى






بارك الله فيكم
شكراَ لك أخي على دعمك لموقعنا
بارك الله فيكم
جزاك الله خيراً أخي على دعمك
كيف احدد اكبر حجم ذري
بالعلم
اكبر عدد زري هو الا حجمة اكبر
شكرا لكم اخوتي علي هذه المعلومات المفيده ووفقكم الله الي كل خير
شكرا جزيلا لكم فهمتها جيدا . نتمنى مزيدا من التقدم والنجاح.
سلام عليكم يا شباب
ايهما اكبر ف الميل ايونات النيترجين +1 ام -2