الكيمياءالكيمياء العامة
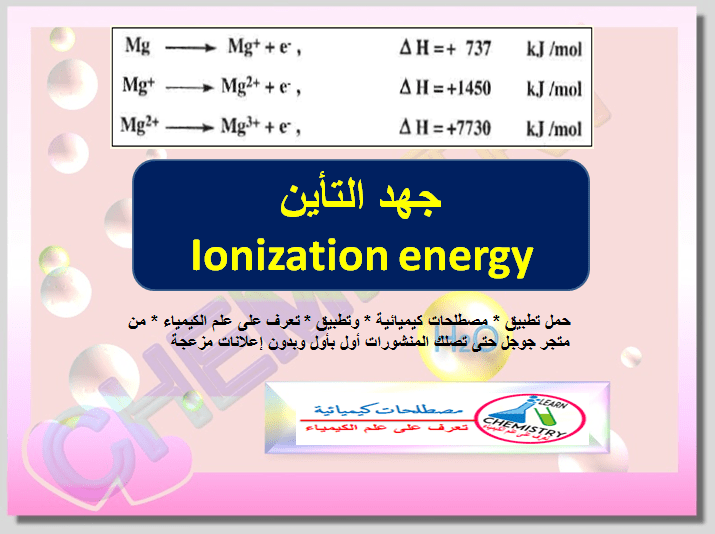
جهد التأين (طاقة التأين) Ionization energy
تعريف جهد
التأين (طاقة التأين)
مقدار الطاقة اللازمة لإزالة أو فصل أقل الإلكترونات ارتباطاً بالذرة المفردة وهى في الحالة الغازية
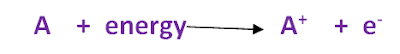

ملاحظات هامة
1- جهد التأين
ماص للحرارة ( + )
2- قد يوجد
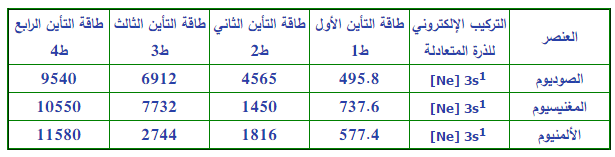
للعنصر أكثر من جهد تأين لأنه من الممكن إزالة إلكترون أو أثنين أو ثلاثة من الذرة
فقد يوجد للذرة جهد تأين أول وثان وثالث…. الخ
للعنصر أكثر من جهد تأين لأنه من الممكن إزالة إلكترون أو أثنين أو ثلاثة من الذرة
فقد يوجد للذرة جهد تأين أول وثان وثالث…. الخ
3- جهد التأين
الأول للغازات النبيلة مرتفع جداً لإستقرار نظامها الإلكتروني حيث يصعب إزالة
إلكترون من مستوي طاقة مكتمل
الأول للغازات النبيلة مرتفع جداً لإستقرار نظامها الإلكتروني حيث يصعب إزالة
إلكترون من مستوي طاقة مكتمل
4- جهد التأين
الثاني أكبر من جهد التأين الأول وذلك لزيادة شحنة النواة عن شحنة الألكترونات
المتبقية فى الذرة مما يزيد من قوة جذب النواة للإلكترونات
الثاني أكبر من جهد التأين الأول وذلك لزيادة شحنة النواة عن شحنة الألكترونات
المتبقية فى الذرة مما يزيد من قوة جذب النواة للإلكترونات
5- الجهد الـتأين الثالث يكون أكبر من جهدى التأين الأول والثاني وذلك لأنه قد يتسبب فى كسر مستوى طاقة مكتمل كما فى ذرة الماغنسيوم

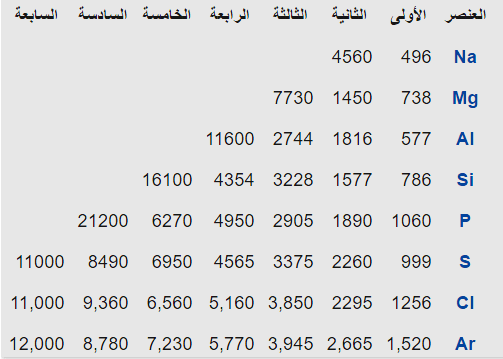
جدول يوضح طاقات التأين لعناصر الصوديوم – الماغنسيوم – الألومنيوم
قياس جهد التأين
حسب التفسير الكهروستاتيكي ونموذج بور يقاس جهد التأين من العلاقة الآتية :
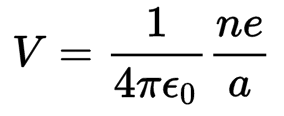
= جهد التأين V
= شحنة الإلكترون e
= عدد الالكترونات المفقودة من الذرة n
= نصف قطر بور a
وحيث أن الإلكترون له شحنة سالبة، ومنجذب إلى الجهد الموجب للنواة (وقيمة
هذا الجهد يسمى جهد التأين ) فتلزمه طاقة ليقفز ويترك الذرة وتحدد هذه الطاقة من
العلاقة :
هذا الجهد يسمى جهد التأين ) فتلزمه طاقة ليقفز ويترك الذرة وتحدد هذه الطاقة من
العلاقة :
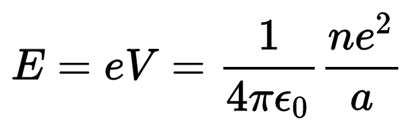
ويوجد تفسير آخر لطاقة التأين طبقاً لميكانيكا الكم حيث يتم وصف الإلكترون كسحابة للأماكن المتوقع وجوده فيها وهى تعطي لتواجد الإلكترون احتمالات تتراوح بين القرب والبعد عن النواة ويمكن بميكانيكا الكم حساب الطاقة بتكامل هذه السحابة
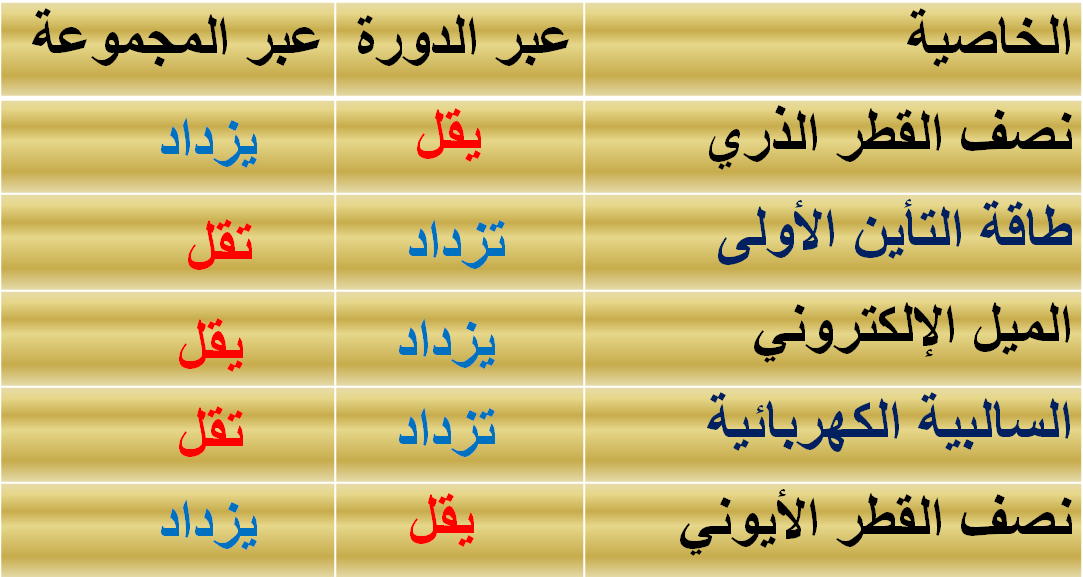
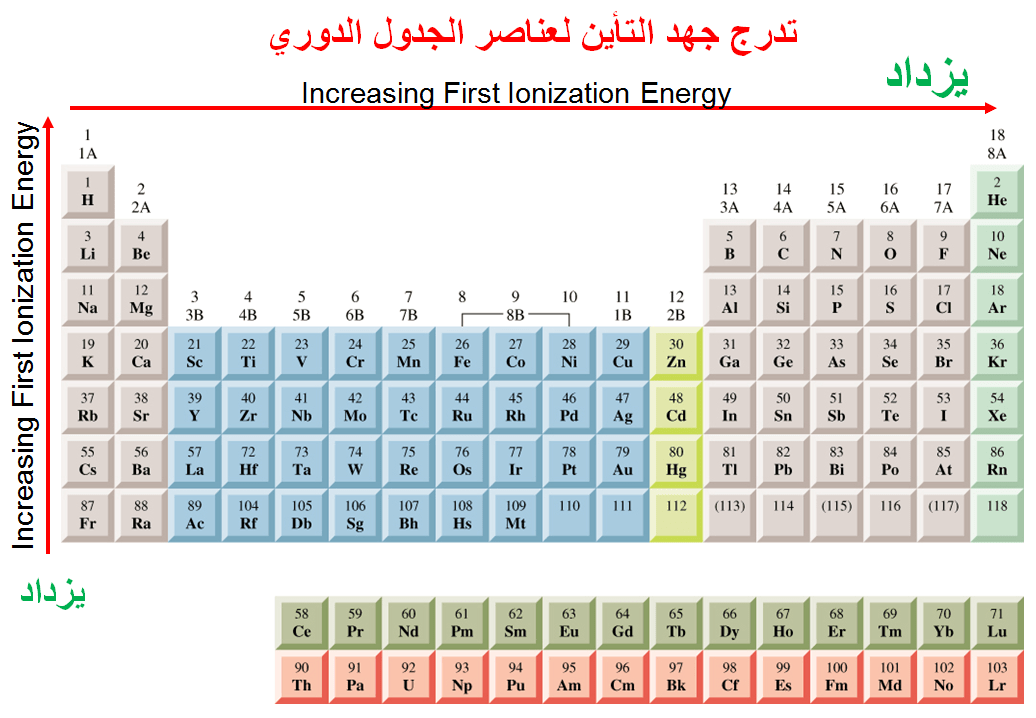
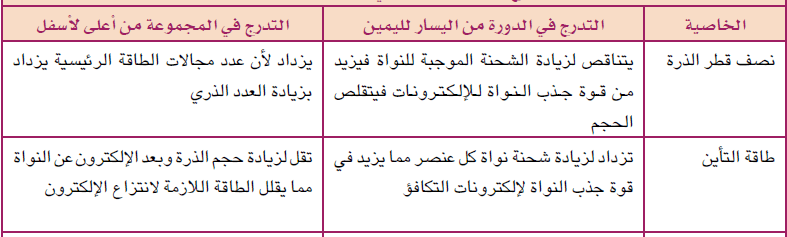
تدرج جهد التأين
للعناصر في الجدول الدوري
1- في
الدورات الأفقية :-
تزداد قيم جهد التأين كلما اتجهنا ناحية يمين الجدول أي
بزيادة العدد الذرى
السبب في ذلك:- نقص نصف قطر الذرة (نقص الحجم) مما يؤدى
إلى اقتراب إلكترونات التكافؤ من النواة فتحتاج إلى طاقة كبيرة لفصلها عن الذرة
2- في المجموعة
الرأسية:-
الرأسية:-
يقل جهد التأين من أعلى إلى أسفل أي بزيادة
العدد الذري
السبب في ذلك هو زيادة نصف القطر وذلك بسبب
أ- زيادة عدد
المستويات الرئيسية
ب- يزداد حجب
شحنة النواة بسبب وجود المستويات الحاجبة
ج- فيبتعد الإلكترون عن النواة فتسهل إزالته
العدد الذري
السبب في ذلك هو زيادة نصف القطر وذلك بسبب
أ- زيادة عدد
المستويات الرئيسية
ب- يزداد حجب
شحنة النواة بسبب وجود المستويات الحاجبة
ج- فيبتعد الإلكترون عن النواة فتسهل إزالته
الجدول التالي يوضح
بعض قيم طاقة التأين لعناصر الدورة الثالثة بوحدة كيلو جول لكل مول
بعض قيم طاقة التأين لعناصر الدورة الثالثة بوحدة كيلو جول لكل مول
العلاقة بين جهد التأين ونصف قطر الذرة
جهد التأين يتناسب عكسياً مع نصف القطر الذرية وهذة مقارنة توضح ذلك :
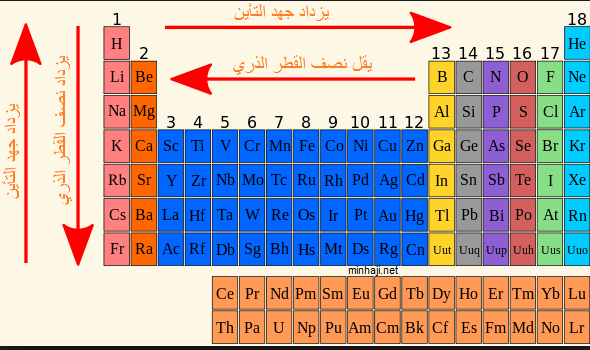
مقارنة توضح تدرج الخواص للعناصر فى الجدول الدورى