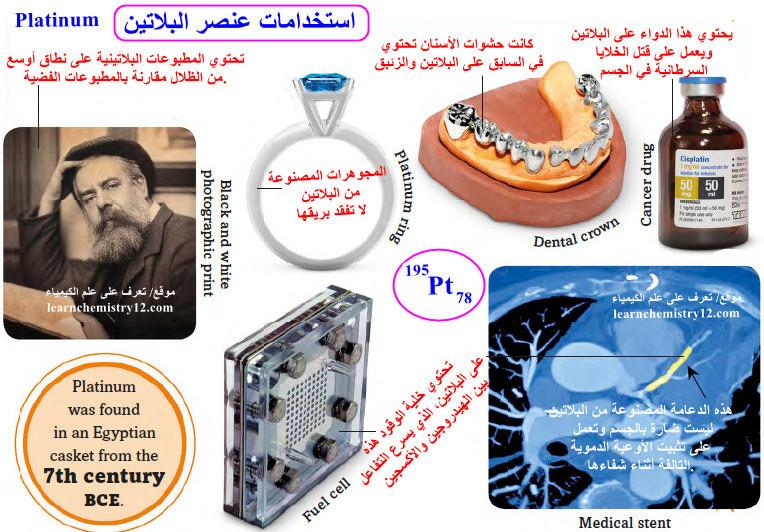
الكيمياءالكيمياء العامة
علاقة قوة الحمض بصيغته البنائية Strength of the acid and its Molecular structure
علاقة
قوة الحمض بصيغته البنائية
قوة الحمض بصيغته البنائية
Strength of the acid and its Molecular (Formula) structure
لمناقشة
علاقة البنية الجزيئية وقوة الحمض يكون من الضروري تقسيم الأحماض على قسمين رئيسين
(I) الهيدريدات ، (II) الأحماض الأكسجينية
علاقة البنية الجزيئية وقوة الحمض يكون من الضروري تقسيم الأحماض على قسمين رئيسين
(I) الهيدريدات ، (II) الأحماض الأكسجينية
أولاً:
الهيدريدات أو الأحماض الهيدريدية Hydrid
acid
** مثال:
HCl, H2S
HCl, H2S
** هناك عاملان يؤثران على قوة الحمض لهيدريد العنصر وهما سالبية العنصر الكهربائية
وحجم ذرته فالعامل الأول يمكن تقديره بمقارنة أحماض هيدريدات عناصر دورة (period) في الجدول الدوري بينما العامل الثاني يمكن تقديره بمقارنة مجموعة
(group) في الجدول الدوري.
وحجم ذرته فالعامل الأول يمكن تقديره بمقارنة أحماض هيدريدات عناصر دورة (period) في الجدول الدوري بينما العامل الثاني يمكن تقديره بمقارنة مجموعة
(group) في الجدول الدوري.
(1) هيدريدات عناصر دورة
** نجد
أن قوة الحمض لهيدريدات عناصر دورة في الجدول الدوري تزداد من اليسار إلى اليمين
في الدورة بنفس ترتيب السالبية الكهربائية لهذه العناصر حيث نتوقع للعنصر الأكثر
سالبيه أن يسحب إلكترونات من الهيدروجين ويسهل تحررها كبروتون .
أن قوة الحمض لهيدريدات عناصر دورة في الجدول الدوري تزداد من اليسار إلى اليمين
في الدورة بنفس ترتيب السالبية الكهربائية لهذه العناصر حيث نتوقع للعنصر الأكثر
سالبيه أن يسحب إلكترونات من الهيدروجين ويسهل تحررها كبروتون .
** لو
أخذنا في الاعتبار N,
O,F عناصر المجموعة الثانية
نجد أن السالبية الكهربائية لهذه العناصر تزداد بالترتيب N<O<F وتزداد قوة أحماض
هيدريداتها بنفس الترتيب فنجد NH3
< H2O < HF ولو بحثنا في المحاليل
المائية لهذه الهيدريدات الثلاثة نجد الاتي:
أخذنا في الاعتبار N,
O,F عناصر المجموعة الثانية
نجد أن السالبية الكهربائية لهذه العناصر تزداد بالترتيب N<O<F وتزداد قوة أحماض
هيدريداتها بنفس الترتيب فنجد NH3
< H2O < HF ولو بحثنا في المحاليل
المائية لهذه الهيدريدات الثلاثة نجد الاتي:
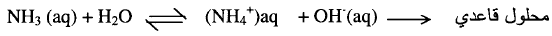
ويتحلل
الماء إلى مدى صغير مكوناً تركيز قليل من أيون الهيدرونيوم (H3O+) وأيون الهيدروكسيد (OH–)aq
الماء إلى مدى صغير مكوناً تركيز قليل من أيون الهيدرونيوم (H3O+) وأيون الهيدروكسيد (OH–)aq
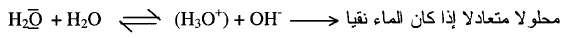
بينما
محلولاً مائياً لفلوريد الهيدروجين (HF) يكون حمضياً
محلولاً مائياً لفلوريد الهيدروجين (HF) يكون حمضياً
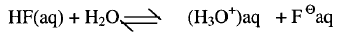
** ولو أخذنا في الاعتبار P,
S, Cl عناصر الدورة الثالثة نجد
أن سالبيتها الكهربائية تزداد من اليسار إلى اليمين P < S < Cl وتزداد قوة هذه
الهيدريدات بنفس الترتيب حيث نجد الفسفور لا يتفاعل مع الماء بينما الكبريت يكون
كبريتيد الهيدروجين (H2S) كحمض ضعيف بينما الكلور يكون حمضاً قوياً هو
(HCl)
S, Cl عناصر الدورة الثالثة نجد
أن سالبيتها الكهربائية تزداد من اليسار إلى اليمين P < S < Cl وتزداد قوة هذه
الهيدريدات بنفس الترتيب حيث نجد الفسفور لا يتفاعل مع الماء بينما الكبريت يكون
كبريتيد الهيدروجين (H2S) كحمض ضعيف بينما الكلور يكون حمضاً قوياً هو
(HCl)

(2) هيدريدات عناصر مجموعة
** لو
درسنا حمضية هيدريدات عناصر المجموعة VII (A) ، VI (A) نجد أن هناك عاملين
يؤثران على قوة الحمض هما السالبية الكهربائية وحجم الذرة المركزية حيث يكون حجم
الذرة المركزية هو الأهم في تحديد قوة حمضية الهيدريد ضمن مجموعة في الجدول الدوري
فإذا تعارض تأثير هذين العاملين فإن تأثير حجم الذرة هو الذي يتغلب حيث يسهل نزع بروتون
الهيدريد كلما كان حجم الذرة المركزية كبيراً وحيث يسهل نزع بروتون الهيدريد كلما
كان حجم الذرة المركزية كبيراً وحيث إن نصف قطر الذرات للمجموعة (VIIA) تزداد من الذرة الأخف إلى الأثقل وفقاً للتالي:
درسنا حمضية هيدريدات عناصر المجموعة VII (A) ، VI (A) نجد أن هناك عاملين
يؤثران على قوة الحمض هما السالبية الكهربائية وحجم الذرة المركزية حيث يكون حجم
الذرة المركزية هو الأهم في تحديد قوة حمضية الهيدريد ضمن مجموعة في الجدول الدوري
فإذا تعارض تأثير هذين العاملين فإن تأثير حجم الذرة هو الذي يتغلب حيث يسهل نزع بروتون
الهيدريد كلما كان حجم الذرة المركزية كبيراً وحيث يسهل نزع بروتون الهيدريد كلما
كان حجم الذرة المركزية كبيراً وحيث إن نصف قطر الذرات للمجموعة (VIIA) تزداد من الذرة الأخف إلى الأثقل وفقاً للتالي:

نجد
أن ترتيب قوة حمضية هذه العناصر ليس بترتيب حجومها حيث أن HI هو أقوى هذه الأحماض.
أن ترتيب قوة حمضية هذه العناصر ليس بترتيب حجومها حيث أن HI هو أقوى هذه الأحماض.
** نجد
أيضاً نصف قطر عناصر المجموعة (VIA) تزداد من أعلي إلى أسفل أي من الذرة الأخف
إلى الأثقل.
أيضاً نصف قطر عناصر المجموعة (VIA) تزداد من أعلي إلى أسفل أي من الذرة الأخف
إلى الأثقل.
O < S < Se < Te
عليه
نجد أن ترتيب قوة هذه الأحماض هو نفس ترتيب حجوم ذراتها.
نجد أن ترتيب قوة هذه الأحماض هو نفس ترتيب حجوم ذراتها.
H2O < H2S < H2Se < H2Te
** وإذا قارنا هيدريدات
العناصر I, S, C وهي تتبع مجموعات مختلفة ولكن أنصاف أقطارها
مختلفة.
العناصر I, S, C وهي تتبع مجموعات مختلفة ولكن أنصاف أقطارها
مختلفة.

بينما
سالبيتها تقريباً متساوية = 2.5 ، ولذلك نجد أن حمضية هيدريداتها تزداد مع زيادة حجم الذرة
المركزية.
سالبيتها تقريباً متساوية = 2.5 ، ولذلك نجد أن حمضية هيدريداتها تزداد مع زيادة حجم الذرة
المركزية.
ثانياً:
الأحماض الأكسجينية Oxyacid
(1) أحماض أكسجينية تحتوي على ذرة أكسجين واحدة
** مثال: HOI , HOBr ,
HOCl
HOCl
** جميعها
تشترك في البنية العامة :
تشترك في البنية العامة :
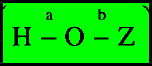
حمض
بذرة (O) واحدة حيث ذرة الهيدروجين الحمضية لهذه
الأحماض مرتبطة بذرة الأكسجين عن طريق الرباط (a) والعامل الرئيسي في تحديد
قوة الحمض هو السالبية الكهربائية للذرة (Z).
بذرة (O) واحدة حيث ذرة الهيدروجين الحمضية لهذه
الأحماض مرتبطة بذرة الأكسجين عن طريق الرباط (a) والعامل الرئيسي في تحديد
قوة الحمض هو السالبية الكهربائية للذرة (Z).
** فإذا
كانت الذرة (Z) فلزاً سالبيته الكهربائية ضعيفة مثل (Na) فإن إلكترونات الرباط (b) ستنحاز تماماً تقريباً
لذرة (O) حيث سالبيتها الكهربائية كبيرة فإن المركب
سيكون هيدروكسيداً أيونياً إى قاعدة مثل:
كانت الذرة (Z) فلزاً سالبيته الكهربائية ضعيفة مثل (Na) فإن إلكترونات الرباط (b) ستنحاز تماماً تقريباً
لذرة (O) حيث سالبيتها الكهربائية كبيرة فإن المركب
سيكون هيدروكسيداً أيونياً إى قاعدة مثل:
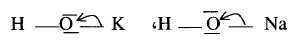
وإذا
كانت الذرة (Z) لافلز سالبيته الكهربائية كبيرة مثل
الهالوجين (X) فإن الوضع سيكون مختلفاً حيث إلكترونات
الرباط (b) ستكون رباطاً تساهمياً قوياً وليس أيونياً
وتسحب الذرة Z إلكترونات من ذرة الأكسجين (O) ومن ثم تسحب ذرة الأكسجين إلكترونات من الرباط (a) بعيداً عن ذرة (H) مسهلة تأينها ويكون المركب حمضياً وكمثال
على ذلك الحمض H-O-Cl حمض الهيبووكلوروز Hypochlorous acid
كانت الذرة (Z) لافلز سالبيته الكهربائية كبيرة مثل
الهالوجين (X) فإن الوضع سيكون مختلفاً حيث إلكترونات
الرباط (b) ستكون رباطاً تساهمياً قوياً وليس أيونياً
وتسحب الذرة Z إلكترونات من ذرة الأكسجين (O) ومن ثم تسحب ذرة الأكسجين إلكترونات من الرباط (a) بعيداً عن ذرة (H) مسهلة تأينها ويكون المركب حمضياً وكمثال
على ذلك الحمض H-O-Cl حمض الهيبووكلوروز Hypochlorous acid
** وعموماً
كلما زادت السالبية الكهربائية للذرة (Z) كلما زاد سحب الإلكترونات
من الرباط (H-O) (a) بعيداً عن ذرة (H) ويكون من السهل فقد هذه
الذرة كبروتون (H+) ونجد أن ترتيب قوة هذه الأحماض كالتالي:
كلما زادت السالبية الكهربائية للذرة (Z) كلما زاد سحب الإلكترونات
من الرباط (H-O) (a) بعيداً عن ذرة (H) ويكون من السهل فقد هذه
الذرة كبروتون (H+) ونجد أن ترتيب قوة هذه الأحماض كالتالي:
HOI < HOBr < HOCl
حيث
تزداد سالبية الذرة (Z). I < Br < Cl وتزداد قوة هذه الأحماض بنفس الترتيب.
تزداد سالبية الذرة (Z). I < Br < Cl وتزداد قوة هذه الأحماض بنفس الترتيب.
(2) أحماض أكسجينية بأكثر من ذرة أكسجين واحدة
** مثال:
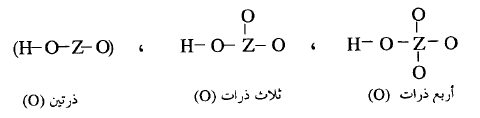
(i) الأحماض الأكسجينية
للهالوجينات
للهالوجينات
إذا
درسنا الأحماض الأكسجينية للهالوجينات (I, Br, Cl) حيث تمثل الذرة (Z) لذرة هالوجينية نجد أن سالبية هذه الهالوجينات تزداد وفقاً
للترتيب I < Br <
Cl ونجد أن قوة أحماضها تزداد بنفس الترتيب HI
< HBr < HClحيث
ذرات الأكسجين المتزايدة في العدد تسحب إلكترونات بعيدأ عن الذرة المركزية (Z) وتجعلها موجبة ومن ثم تجعلها أكثر تأثيراً في سحب الكثافة
الإلكترونية بعيداً عن ذرة الأكسجين المرتبطة بذرة هيدروجين الحمض وهذه بدورها
تسحب الإلكترونات بعيداً عن ذرة (H) مسهلة انفصالها كبروتون (H+) وبذلك تزداد قوة الحمض.
عليه
يكون كلما زاد عدد ذرات الأكسجين المرتبطة بالذرة المركزية (Z) كلما زادت قوة الحمض كما يتضح من ترتيب قوة الأحماض الأكسجينية
الهالوجينية الآتية :
يكون كلما زاد عدد ذرات الأكسجين المرتبطة بالذرة المركزية (Z) كلما زادت قوة الحمض كما يتضح من ترتيب قوة الأحماض الأكسجينية
الهالوجينية الآتية :
(ii) الأحماض الأكسجينية لذرة
الكلور

الكلور
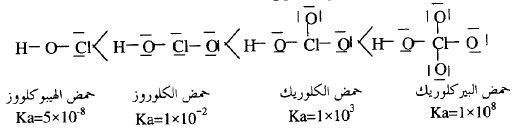
** نلاحظ
في هذا الترتيب تزداد قوة الحمض كلما زادت الشحنات الموجبة على الذرة المركزية (Cl) كلما انسحبت إلكترونات الرباط (H-O) بعيداً عن ذرة (H) ومن ثم تزداد قوة الحمض.
في هذا الترتيب تزداد قوة الحمض كلما زادت الشحنات الموجبة على الذرة المركزية (Cl) كلما انسحبت إلكترونات الرباط (H-O) بعيداً عن ذرة (H) ومن ثم تزداد قوة الحمض.
* وباستخدام
رقم الأكسدة للأحماض الأكسجينية للكلور نجد أن رقم الأكسدة يزداد مع زيادة الشحنة
ولكن هذا مؤشراً لا يعتمد عليه حيث الشحنة هي الأكثر معياراً.

رقم الأكسدة للأحماض الأكسجينية للكلور نجد أن رقم الأكسدة يزداد مع زيادة الشحنة
ولكن هذا مؤشراً لا يعتمد عليه حيث الشحنة هي الأكثر معياراً.
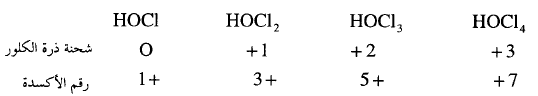
** وسنرى ذلك واضحاً بدراسة الأحماض الأكسجينية الفسفورية حيث جميعها أحماض ضعيفة لها
نفس القوة ولكن شحنات ذرتها المركزية (P) واحدة ولكن رقم أكسدة ذرة
الفسفور المركزية مختلفة إذا يجب الاعتماد على شحنة الذرة المركزية وليس على رقم
أكسدتها لتحديد قوة الحمض.
نفس القوة ولكن شحنات ذرتها المركزية (P) واحدة ولكن رقم أكسدة ذرة
الفسفور المركزية مختلفة إذا يجب الاعتماد على شحنة الذرة المركزية وليس على رقم
أكسدتها لتحديد قوة الحمض.
(iii) الأحماض الأكسجينية لذرة
الفوسفور (P)

الفوسفور (P)
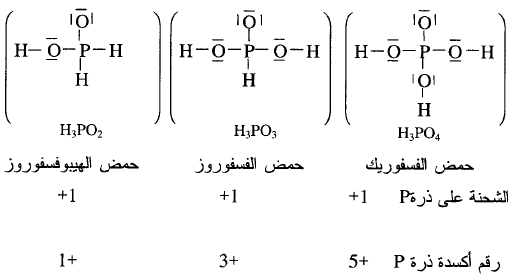
بملاحظة
الشحنة على الذرة المركزية (P) نجد أن قوة هذه الأحماض الثلاثة متساوية أي لا
يوجد اختلاف بين قوتها وهو الحاصل عملياً. ولو اعتمدنا على رقم الأكسدة لكان هناك
اختلاف في قوتها وهذا ليس صحيحاً عملياً ويمكننا مقارنة قوة الأحماض الأكسجينية لعدد
ذرات الأكسجين المرتبطة بالذرة المركزية (Z) وليس المرتبطة بذرة
الهيدروجين الحمضية كما هو الحال في حمض النيتريك والنيتروز ، وحمض الكبريتيك
والكبريتوز.

الشحنة على الذرة المركزية (P) نجد أن قوة هذه الأحماض الثلاثة متساوية أي لا
يوجد اختلاف بين قوتها وهو الحاصل عملياً. ولو اعتمدنا على رقم الأكسدة لكان هناك
اختلاف في قوتها وهذا ليس صحيحاً عملياً ويمكننا مقارنة قوة الأحماض الأكسجينية لعدد
ذرات الأكسجين المرتبطة بالذرة المركزية (Z) وليس المرتبطة بذرة
الهيدروجين الحمضية كما هو الحال في حمض النيتريك والنيتروز ، وحمض الكبريتيك
والكبريتوز.
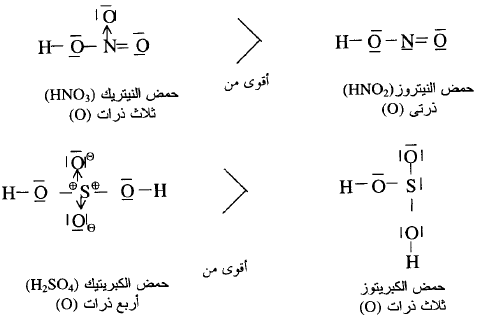
قوة
الأحماض الأكسجينية
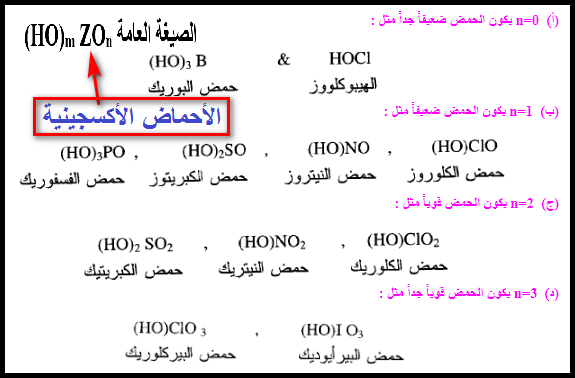
** عموماً فأن قوة الأحماض الأكسجينية التي لها الصيغة العامة (HO)m ZOn يمكن مقارنتها وفقاً لقيمة (n) وهى عدد ذرات الأكسجين المرتبطة بالذرة المركزية وليس بذرة
الهيدروجين الحمضية كالاتي:
الهيدروجين الحمضية كالاتي:
(أ) n=0 يكون الحمض
ضعيفاً جداً مثل :

ضعيفاً جداً مثل :
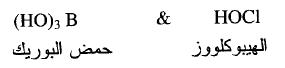
(ب) n=1 يكون الحمض
ضعيفاً مثل :

ضعيفاً مثل :
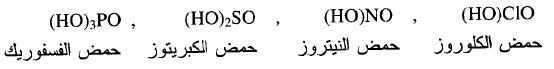
(ج) n=2 يكون الحمض
قوياً مثل :

(د) n=3 يكون الحمض
قوياً جداً مثل :

تأثير
المجموعات الساحبة للإلكترونات في الأحماض العضوية
** نجد أن في جزئ الإيثانول لا تتأين ذرة (H)
في جزئ الإيثانول بإذابته في الماء. بينما في جزئ حمض الأستيك ادخلنا ذرة أكسجين
بدلاً من ذرتي (H) مكونة مجموعة الكربوكسيل حيث نجد أن ذرة الهيدروجين (H)
فقط المرتبطة بالرباط (H-O) هي الحمضية وتتأين كحمض ضعيف.
في جزئ الإيثانول بإذابته في الماء. بينما في جزئ حمض الأستيك ادخلنا ذرة أكسجين
بدلاً من ذرتي (H) مكونة مجموعة الكربوكسيل حيث نجد أن ذرة الهيدروجين (H)
فقط المرتبطة بالرباط (H-O) هي الحمضية وتتأين كحمض ضعيف.
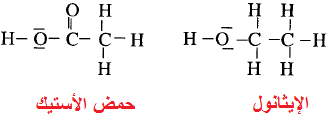
** كل الأحماض العضوية هي أحماض
كربوكسيلية تتبع المجموعة (n=1) لها الصيغة العامة التالية:
كربوكسيلية تتبع المجموعة (n=1) لها الصيغة العامة التالية:
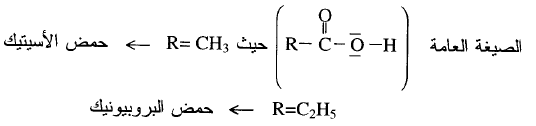
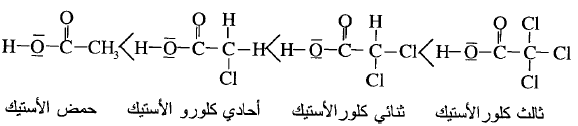
وباستبدال ذرة الهيدروجين في مجموعة
الألكيل (R) بذرة لها سالبية كهربائية كبيرة مثل (Cl)
فإن قوة الحمض تزداد
الألكيل (R) بذرة لها سالبية كهربائية كبيرة مثل (Cl)
فإن قوة الحمض تزداد
المراجع: مبادئ الكيمياء العامة (نظري – مسائل محلولة) / محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش / الطبعة الثانية (2003) / شركة الجا للنشر العلمي – طرابلس.