الكيمياءالكيمياء العامة
الأملاح المتبلرة وماء التبلر Hydrates and Water of Crystallization

تعريف
الأملاح المتبلرة Definition
of Hydrates
يدخل
الماء مع أملاح وأيونات معينة مكوناً الملح المائي (Hydrates) ويمكن الحصول على هذه الأملاح
المائية بإذابة الملح في الماء ثم تبخير المحلول حيث ينفصل الملح متحداً مع عدد من
جزئيات الماء يسمى الملح المائي وتسمى جزئيات الماء المتحدة معه بماء التبلر (Water of Crystallization or Water of
hydration). ولقد
ثيت ذلك بالتحليل الكيميائي ويمكن لماء التبلر أن يطرد بالتسخين ليعطي الملح
اللامائي.
الماء مع أملاح وأيونات معينة مكوناً الملح المائي (Hydrates) ويمكن الحصول على هذه الأملاح
المائية بإذابة الملح في الماء ثم تبخير المحلول حيث ينفصل الملح متحداً مع عدد من
جزئيات الماء يسمى الملح المائي وتسمى جزئيات الماء المتحدة معه بماء التبلر (Water of Crystallization or Water of
hydration). ولقد
ثيت ذلك بالتحليل الكيميائي ويمكن لماء التبلر أن يطرد بالتسخين ليعطي الملح
اللامائي.
أمثلة
على الأملاح المتبلرة
(1) كبريتات
النحاس المائية (المعروفة بالفينول الأزرق) – الصيغة الكيميائية: CuSO4.5H2O
النحاس المائية (المعروفة بالفينول الأزرق) – الصيغة الكيميائية: CuSO4.5H2O
(2) كبريتات الماغنسيوم (المعروفة بملح أبسوم) – الصيغة
الكيميائية: MgSO4.7H2O
الكيميائية: MgSO4.7H2O
(3) كبريتات البوتاسيوم والألومنيوم (المعروفة بالشب
Alum) –
الصيغة الكيميائية: KAl(SO4)2.12H2O
Alum) –
الصيغة الكيميائية: KAl(SO4)2.12H2O
(4) كبريتات الصوديوم (المعروفة بملح جلوبر) –
الصيغة الكيميائية: Na2SO4.10H2O
الصيغة الكيميائية: Na2SO4.10H2O
(5) كبريتات النيكل – الصيغة الكيميائية: NiSO4.7H2O
(6) كربونات الصوديوم – الصيغة الكيميائية: Na2CO3.10H2O
(7) حمض الكبريتيك – الصيغة الكيميائية: H2SO4.
H2O
H2O
(8) كبريتات الباريوم – الصيغة الكيميائية: BaSO4.8H2O
(9) غاز الكلور – الصيغة الكيميائية: Cl2.6H2O
(10) حمض الأكساليك – الصيغة الكيميائية: H2C2O4.2H2O
ويمكن أن يتواجد الماء في بلورات
الأملاح المائية في خمس صور مختلفة
الأملاح المائية في خمس صور مختلفة
أنواع
ماء التبلر Types of Water
of Crystallization
(1) الماء الهيدروكسيلي Water of Hydroxylation
** حيث يتواجد الماء في هذه الصورة من الصور الخمس على هيئة أيون
هيدروكسيل (OH–) وهي حالات هيدروكسيد الفلز مثل: Mg(OH)2
، NaOH ، Al(OH)3
هيدروكسيل (OH–) وهي حالات هيدروكسيد الفلز مثل: Mg(OH)2
، NaOH ، Al(OH)3
** نزع هذه المياه الهيدروكسيلية يغير من بنية المركب ويكون مركباً
آخر يختلف عنه كلية.
آخر يختلف عنه كلية.
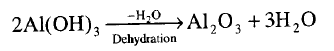
** عادةً ما تحضر أكاسيد الفلزات
بتسخين هيدروكسيداتها مثل حالة Al(OH)3
ونترات وكربونات الفلز ولكن أكاسيد الفلزات القاعدية النشطة لا تحضر بهذه الطريقة
لأن هيدروكسيداتها ونتراتها وكربوناتها ثابته عند تسخينها وتحلل فقط في درجة
الحرارة العالية ولكن نحصل على أكاسيد هذه الفلزات القاعدية بتسخين هيدروكسيداتها
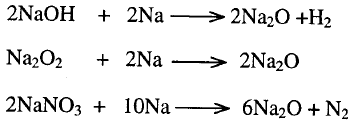
أو بيروكسيداتها أو نتراتها مع الصوديوم وفقاً للتفاعلات الآتية:
بتسخين هيدروكسيداتها مثل حالة Al(OH)3
ونترات وكربونات الفلز ولكن أكاسيد الفلزات القاعدية النشطة لا تحضر بهذه الطريقة
لأن هيدروكسيداتها ونتراتها وكربوناتها ثابته عند تسخينها وتحلل فقط في درجة
الحرارة العالية ولكن نحصل على أكاسيد هذه الفلزات القاعدية بتسخين هيدروكسيداتها
أو بيروكسيداتها أو نتراتها مع الصوديوم وفقاً للتفاعلات الآتية:
(2) ماء التبلر (المرتبط بروابط تناسقية) أو الماء الكاتيوني Water
of Coordination or Cation Water
** حيث يتواجد الماء في هذا النوع من ماء التبلر مرتبطاً بروابط
تناسقية مع الفلز مثل بلورات كبريتات البريليوم BeSO4.4H2O
حيث صيغتها البنائية [Be(H2O)4]++ (SO4) —
، وكبريتات النيكل NiSO4.6H2O
وصيغتها البنائية [Ni(H2O)6]++ (SO4) –
تناسقية مع الفلز مثل بلورات كبريتات البريليوم BeSO4.4H2O
حيث صيغتها البنائية [Be(H2O)4]++ (SO4) —
، وكبريتات النيكل NiSO4.6H2O
وصيغتها البنائية [Ni(H2O)6]++ (SO4) –
** هذا النوع من الماء هو جزء أساسي
وضروري في بنية المركب البلورية ولثبات واستقرار بلوراته بل وتحسب كتلة ماء التبلر
في حساب وزنه الجزيئي.
وضروري في بنية المركب البلورية ولثبات واستقرار بلوراته بل وتحسب كتلة ماء التبلر
في حساب وزنه الجزيئي.
(3) الماء الأنيوني Anion Water
** حيث ترتبط بعض جزئيات ماء التبلر
مع أنيون المركب أو الملح بواسطة روابط هيدروجينية Hydrogen
bonding وترتبط بقية جزئيات ماء التبلر بكاتيون المركب أو الملح مثل
كبريتات النحاس المائية CuSO4.5H2O
حيث نجد أربعة جزئيات لماء التبلر من الخمسة مرتبطة بكاتيون المركب (Cu+2)
والجزئ الخامس بأنيون المركب SO4—
وتكون صيغته البنائية : [Cu(H2O)4]+2 [SO4.H2O] -2 ، حيث تم تأكيد ذلك بدراسته في فرع الكيمياء البلورية.
مع أنيون المركب أو الملح بواسطة روابط هيدروجينية Hydrogen
bonding وترتبط بقية جزئيات ماء التبلر بكاتيون المركب أو الملح مثل
كبريتات النحاس المائية CuSO4.5H2O
حيث نجد أربعة جزئيات لماء التبلر من الخمسة مرتبطة بكاتيون المركب (Cu+2)
والجزئ الخامس بأنيون المركب SO4—
وتكون صيغته البنائية : [Cu(H2O)4]+2 [SO4.H2O] -2 ، حيث تم تأكيد ذلك بدراسته في فرع الكيمياء البلورية.
** لوحظ معملياً أنه عند تسخين
كبريتات النحاس المائية يطرد ماء التبلر وتنهار بلوراته وتبقى كبريتات النحاس
اللامائية كمسحوق وليس كبلورات ونفس الشيء يحدث مع كبريتات الصوديوم المائية.
كبريتات النحاس المائية يطرد ماء التبلر وتنهار بلوراته وتبقى كبريتات النحاس
اللامائية كمسحوق وليس كبلورات ونفس الشيء يحدث مع كبريتات الصوديوم المائية.
(4) ماء الشبكة البلورية Lattice Water
** حيث تتخد جزئيات التبلر في بعض الأملاح والمركبات مواقع معينة
ثابته في شبكاتها البلورية ( ولكنها ليست مرتبطة لا بأنيون ولا كاتيون الملح أو
المركب).
ثابته في شبكاتها البلورية ( ولكنها ليست مرتبطة لا بأنيون ولا كاتيون الملح أو
المركب).
** مثال: كبريتات البوتاسيوم
والألومنيوم (المعروفة بالشب Alum) –
الصيغة الكيميائية: KAl(SO4)2.12H2O
والألومنيوم (المعروفة بالشب Alum) –
الصيغة الكيميائية: KAl(SO4)2.12H2O
** نجد أن ستة جزئيات من ماء التبلر
مرتبطة بأيون الألومنيوم بواسطة روابط تناسقية والست الأخريات هي ماء الشبكة
البلورية مرتبة في أماكن محددة حول أيون (K+)
مرتبطة بأيون الألومنيوم بواسطة روابط تناسقية والست الأخريات هي ماء الشبكة
البلورية مرتبة في أماكن محددة حول أيون (K+)
** أهمية الشب في الصناعة ؟
يعتبر الشب من أهم الأملاح المائية
تجارياً حيث يستخدم في صناعة المنسوجات (الصباغة) ، وفي معالجة مياه الشرب بترويق
الماء من المواد والشوائب العالقة إذ تترسب هذه الشوائب في القاع على هيئة هيدروكسيد
ألومنيوم وتستخدم عادة قطعة من القماش حيث يلصق الشب مع نسيج القماش، وبنفس الأسلوب
يستخدم الشب في صناعة الورق بتغطيته بطبقة من هذا الملح، ويستخدم الشب أو كبريتات
الألومنيوم في أسطوانات إطفاء الحرائق حيث يخلط مع بيكربونات الصوديوم منتجاً رغوة
من ثاني أكسيد الكربون وهيدروكسيد الألومنيوم الجيلاتيني وفقاً للمعادلة:
تجارياً حيث يستخدم في صناعة المنسوجات (الصباغة) ، وفي معالجة مياه الشرب بترويق
الماء من المواد والشوائب العالقة إذ تترسب هذه الشوائب في القاع على هيئة هيدروكسيد
ألومنيوم وتستخدم عادة قطعة من القماش حيث يلصق الشب مع نسيج القماش، وبنفس الأسلوب
يستخدم الشب في صناعة الورق بتغطيته بطبقة من هذا الملح، ويستخدم الشب أو كبريتات
الألومنيوم في أسطوانات إطفاء الحرائق حيث يخلط مع بيكربونات الصوديوم منتجاً رغوة
من ثاني أكسيد الكربون وهيدروكسيد الألومنيوم الجيلاتيني وفقاً للمعادلة:
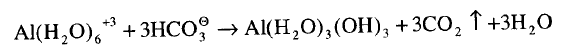
ونفس هذا التفاعل يحدث في مسحوق
الخبيز الذي يستخدم الشب كحمض.
الخبيز الذي يستخدم الشب كحمض.
(5) ماء الزيولايت Zeolite water
الزيولايت هو نوع من الطين المعروف (Mineral
Clay) يستخدم في معالجة عسر المياه عن طريق التبادل الأيوني (Ion
exchange) وهو عبارة عن شبكة مفتوحة من ثلاثة أبعاد من السيلكات (SiO4)
حيث تأخذ جزئيات الماء مواقع عشوائية في شبكته البلوريه ويفقد الماء بدون أي تغير
ظاهري في بنيته البلورية.
Clay) يستخدم في معالجة عسر المياه عن طريق التبادل الأيوني (Ion
exchange) وهو عبارة عن شبكة مفتوحة من ثلاثة أبعاد من السيلكات (SiO4)
حيث تأخذ جزئيات الماء مواقع عشوائية في شبكته البلوريه ويفقد الماء بدون أي تغير
ظاهري في بنيته البلورية.
المراجع: مبادئ الكيمياء العامة (نظري – مسائل محلولة) / محي الدين البكوش – نوري بسيبسو – ياسر حورية – نبيل شيخ قروش / الطبعة الثانية (2003) / شركة الجا للنشر العلمي – طرابلس.