الكيمياءالكيمياء العامة
قانون أفوجادرو وحساب الحجم المولاري Avogadro’s Law and the Molar Volume
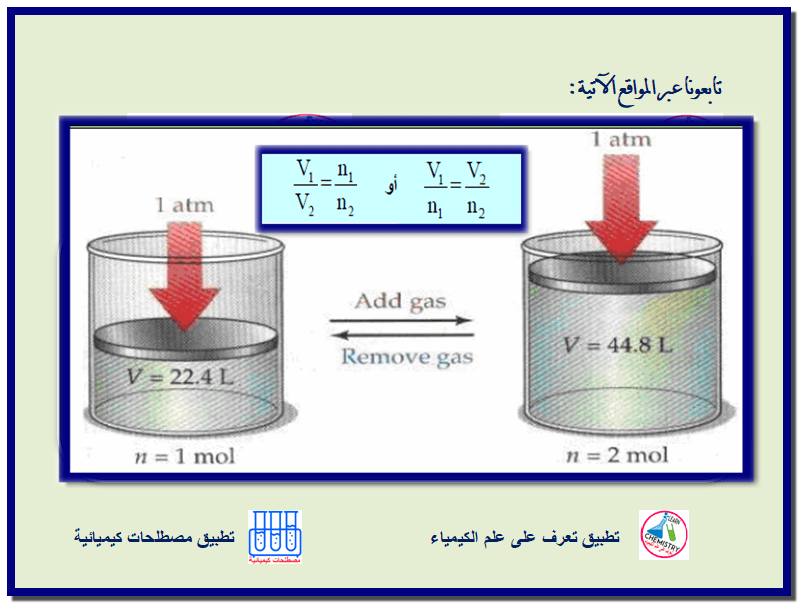
نلاحظ أنه كلما أضفنا مزیداً من الغاز للبالونات أو لإطار سیارة فإنه تزداد أحجامھا، مما یدعونا للاستنتاج أن العوامل المؤثرة على حجم الغاز لیست فقط الضغط (قانون
بويل) ودرجة
الحرارة (قانون
تشارلز) بل كمیة الغاز(n) أيضاً.
بويل) ودرجة
الحرارة (قانون
تشارلز) بل كمیة الغاز(n) أيضاً.
وبعد التوصل الى قانون الحجوم المدمجة لغاي لوساك بفترة قصیرة (بضع سنوات – عام (1811 قام
العالم أفوجادرو (Amadeo Avogadro) بتفسیر ملاحظات غاي لوساك وذلك بأن اقترح ما یعرف بفرضیة أفوجادرو Avogadro’s Hypothesis حیث
أن وجود نسب بسیطة بین الحجوم المتحدة للغازات یؤدي إلى الاقتراح بأنه توجد علاقة بسیطة بین حجم الغاز، وعدد جزیئاته.
العالم أفوجادرو (Amadeo Avogadro) بتفسیر ملاحظات غاي لوساك وذلك بأن اقترح ما یعرف بفرضیة أفوجادرو Avogadro’s Hypothesis حیث
أن وجود نسب بسیطة بین الحجوم المتحدة للغازات یؤدي إلى الاقتراح بأنه توجد علاقة بسیطة بین حجم الغاز، وعدد جزیئاته.
قانون أفوجادرو Avogadro’s Law
النص الأول لقانون أفوجادرو
** تنص فرضیة أفوجادرو (مبدأ أفوجادرو) التي اقترحھا عام1811 على:
“عند نفس الظروف من الضغط ودرجة الحرارة تحتوي الحجوم المتساویة (V) من الغازات
المختلفة على نفس العدد من الجزیئات (N) (أو الذرات في
حالة الغازات وحیدة الذرة) “.
المختلفة على نفس العدد من الجزیئات (N) (أو الذرات في
حالة الغازات وحیدة الذرة) “.
Avogadro postulated that :
At the same temperature and pressure, equal volumes of all
gases contain the same number of molecules.
gases contain the same number of molecules.
** كثير من التجارب أظهرت ان
فرضية أفوجادرو (Avogadro’s hypothesis) دقيقة
في حدود خطاً بحوالي (±2%) وذلك التعبير الآن يعرف
بقانون أفوجادرو .(Avogadro’s Law)
فرضية أفوجادرو (Avogadro’s hypothesis) دقيقة
في حدود خطاً بحوالي (±2%) وذلك التعبير الآن يعرف
بقانون أفوجادرو .(Avogadro’s Law)
** ھذا القانون لا یعني أن تكون حجوم الجزیئات نفسھا متساویة ولكنھا تدل على أن الغازات إذا تساوت حجومھا تحت نفس الظروف من الضغط ودرجة الحرارة، كان عدد جزیئاتھا متساویاً ولا بأس من اختلاف حجوم الجزیئات نفسھا على حساب الفراغ الكائن بینھا.
** تقع أھمیة هذا القانون في أنه يساعد على تتبع التغيرات في عدد الجزيئات
التي تحدث أثناء تفاعل كیمیائي، وذلك بقیاس التغیرات في الحجم الكلي) أو الضغط). ولا
تكون هذه العلاقة صحیحة إلا إذا قیست كمیة الغاز بعدد المولات.
التي تحدث أثناء تفاعل كیمیائي، وذلك بقیاس التغیرات في الحجم الكلي) أو الضغط). ولا
تكون هذه العلاقة صحیحة إلا إذا قیست كمیة الغاز بعدد المولات.
** مثال توضيحي:
عدد الجزيئات فى 5 mol من غاز H2 = عدد الجزيئات فى 5 mol من غاز O2 بينما عدد الجزيئات من غاز H2 في كمية 5g ≠ عدد الجزيئات من غاز الأكسجين O2 في كمية 5g ، بسبب أن عدد
المولات في كلا الكميتين مختلف.
المولات في كلا الكميتين مختلف.
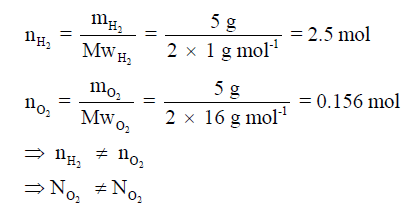
النص الثاني لقانون أفوجادرو
ویمكن أن یصاغ قانون أفوجادرو كالتالي:
“إن حجم الغاز عند درجة حرارة وضغط ثابتين يتناسب طردياً مع عدد
المولات للغازات”
المولات للغازات”
At constant temperature and pressure, the volume, V,
occupied by a gas sample is directly proportional to the number of moles, n, of
gas
occupied by a gas sample is directly proportional to the number of moles, n, of
gas
الصيغة الرياضية لقانون أفوجادرو
حسب قانون أفوجادرو فأن حجم الغاز يتناسب تناسباً طردياً مع عدد المولات عند ثبات درجة الحرارة والضغط:

وھذا معناه أن مضاعفة عدد المولات یضاعف حجم الغاز عند نفس الظروف من الحرارة والضغط

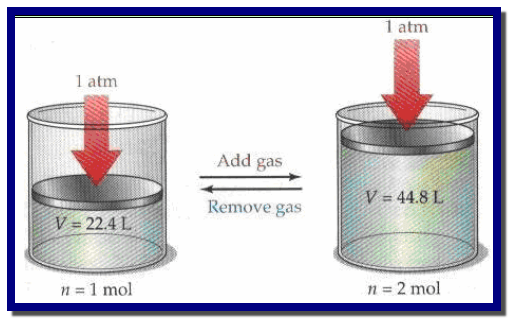
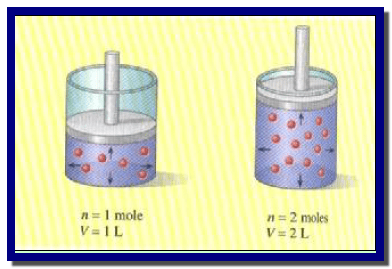
وبفرض وجود غازین مختلفین (A, B) تحت
الضغط ودرجة الحرارة نفسھا فإن المعادلة V = K n تكون الآتي:
الضغط ودرجة الحرارة نفسھا فإن المعادلة V = K n تكون الآتي:
VA = K . nA
VB = K . nB
حيث أن (VA, VB) تمثل حجوم الغازین (A, B)على التوالي للكمیات (nA, nB)ولو فرضنا أن عدد مولات الغازین متساویة فإن: nA = nB
وتحت نفس الضغط ودرجة الحرارة وجد أفوجادرو بأن حجوم الغازین (A, B) تتساوى
أي أن:
أي أن:
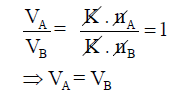
أي أن :
تحتوي المولات المتساویة العدد من الغازات المختلفة على الحجم نفسه عند تساوي الضغط ودرجة الحرارة.
عدد أفوجادرو Avogadro’s number – NA
وقد أثبتت التجارب أن: 22.4 L من
أي غاز عند درجة الصفر المئوي 0 Co وضغط
جوي واحد (1 atm) تحوي 6.023
× 1023 من جزیئات أو ذرات الغاز (وھذا
العدد یعرف بعدد أفوجادرو .(NA أي
أن المول من أي غاز عند (STP) یشغل
حجماً قدره 22.4 L ویعرف
ذلك بالحجم المولاري للغاز.
أي غاز عند درجة الصفر المئوي 0 Co وضغط
جوي واحد (1 atm) تحوي 6.023
× 1023 من جزیئات أو ذرات الغاز (وھذا
العدد یعرف بعدد أفوجادرو .(NA أي
أن المول من أي غاز عند (STP) یشغل
حجماً قدره 22.4 L ویعرف
ذلك بالحجم المولاري للغاز.
NA = 6.023 × 1023
تعريف الحجم المولي أو المولاري Molar Volume
وفق مبدأ أفوجادرو فإن المول من أي غاز یشغل الحجم نفسه عند درجة حرارة وضغط معینین. وقد وجد بالتجربة أن متوسط الحجم الذي یحتله مول واحد من غاز عند STP هو 22.4 dm3 (وھو
نفسه بوحدة اللتر)، وھذا ھو الحجم المولاري Molar Volume لغاز مثالي عند STP .أما بالنسبة للغازات الحقیقیة فإن الحجم المولاري یتراوح حول ھذا المتوسط. ومن ذلك نحصل على القاعدة
الآتية:
نفسه بوحدة اللتر)، وھذا ھو الحجم المولاري Molar Volume لغاز مثالي عند STP .أما بالنسبة للغازات الحقیقیة فإن الحجم المولاري یتراوح حول ھذا المتوسط. ومن ذلك نحصل على القاعدة
الآتية:
“حجم مول واحد من أي غاز عند ثبوت درجة الحرارة والضغط یسمى بالحجم المولي أو الحجم المولاري Molar Volume ويساوي 22.4 L عند STP“
The standard molar
volume of an ideal gas is taken to be 22.4 liters per mole at STP
volume of an ideal gas is taken to be 22.4 liters per mole at STP
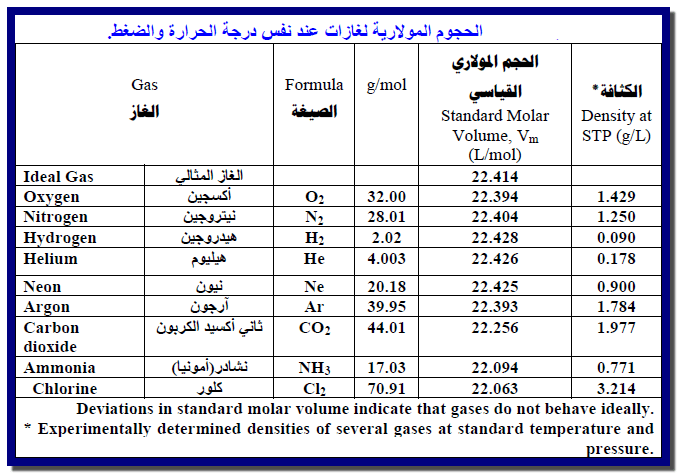
حساب الحجم المولاري Molar Volume
الحجم المولاري (Vm) لعينة
– أي عينة ليست فقط غازاً- هو الحجم المشغول (Volume Occupied)
مقسوماً على عدد المولات (n) من الذرات أو الجزئيات أو
الوحدات الصيغية (Formula Units)
– أي عينة ليست فقط غازاً- هو الحجم المشغول (Volume Occupied)
مقسوماً على عدد المولات (n) من الذرات أو الجزئيات أو
الوحدات الصيغية (Formula Units)

نلاحظ أنه بغض النظر عن ماھیة الغاز، فإن الحجوم المولاریة تقریباً جمیعھا متشابھة. والاختلافات صغیرة تحت الظروف العادیة :وتصبح
أصغر كلما انخفض ضغط الغاز ونرى أن الحیود الأعظم یحدث بالنسبة للغازات سھلة الإسالة إلى أبعد حد، مثل الكلور، وثاني أكسید الكربون.
أصغر كلما انخفض ضغط الغاز ونرى أن الحیود الأعظم یحدث بالنسبة للغازات سھلة الإسالة إلى أبعد حد، مثل الكلور، وثاني أكسید الكربون.
مسائل محلولة
مثال (1): احسب كتلة جزيء الأكسجین (O2) عند الظروف القیاسیة من الضغط ودرجة الحرارة
(P =
760 mmHg, T = 273 K)
760 mmHg, T = 273 K)
الحل:
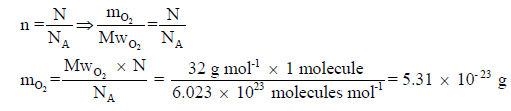
مثال (2): یبلغ حجم مول واحد من غاز ما (V1 = 10 L) عند ضغط محدد ودرجة حرارة محددة ،
فما حجم (V2) عشر مولات (n2 = 10 moles) من ھذا الغاز عند نفس الظروف؟
فما حجم (V2) عشر مولات (n2 = 10 moles) من ھذا الغاز عند نفس الظروف؟
الحل:
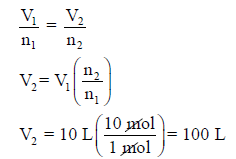
مثال (3): ما الحجم المولي (V2) لغاز
الأكسجين(O2) عند درجة حرارة الغرفة T2 = 25 Co علماً
بأن حجم مول منه عند الظروف القياسية STP يساوي V1 = 22.4 L والظروف القياسية هي : (P = 1
atm , T = 273 K)
الأكسجين(O2) عند درجة حرارة الغرفة T2 = 25 Co علماً
بأن حجم مول منه عند الظروف القياسية STP يساوي V1 = 22.4 L والظروف القياسية هي : (P = 1
atm , T = 273 K)
الحل:
المطلوب ھنا حجم واحد مول من غاز الأكسجین (Vm)عند 298 K (25 .C) ، ومن
المعلوم أن حجم واحد مول من أي غاز عند درجة حرارة 0 Co = 273 K))
يساوي 22.4 L وبتطبيق قانون تشارلز فإن:
المعلوم أن حجم واحد مول من أي غاز عند درجة حرارة 0 Co = 273 K))
يساوي 22.4 L وبتطبيق قانون تشارلز فإن:
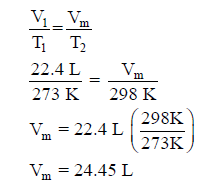
المراجع
– أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية






