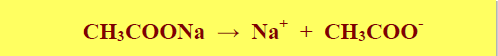حساب الرقم الهيدروجيني pH للمحاليل المنظمة
في هذا الموضوع سيتم مناقشة وحساب الرقم الهيدروجيني pH للمحاليل المنظمة pH laws for buffer solution بالتفصيل.
محتويات الموضوع
تعريف المحاليل المنظمة Buffer solutions
– تُعرف المحاليل المنظمة بأنها المحاليل التي تقاوم التغير في الرقم الهيدروجيني للمحلول عند إضافة حمض أو قاعدة للمحلول أو عند تخفيفه.
مما تتكون المحاليل المنظمة؟
– يتكون المحلول المنظم من حمض ضعيف وملح هذا الحمض أى القاعدة المرافقة للحمض.
– أو يتكون من قاعدة ضعيفة وملحها أى الحامض المرافق لها.
كيف تعمل المحاليل المنظمة؟
– عندما يضاف حمض إلى المحلول المنظم فإن أيونات الهيدروجين تتفاعل مع القاعدة المرافقة.
– عندما تضاف قاعدة للمحلول فإن أيونات الهيدروكسيل تتفاعل مع الحمض المرافق.
حساب الرقم الهيدروجيني pH للمحاليل المنظمة
(أ) حساب الرقم الهيدروجيني لمحلول منظم من حمض ضعيف وأحد أملاحه
– من المحاليل المنظمة التي تتكون من حمض ضعيف وأحد أملاحه محلول حمض الخليك وخلات الصوديوم.
– يتأين خلات الصوديوم تتأين تأين كاملاً عند إذابتها في الماء كما بالمعادلة التالية:
– بينما يتأين حمض الخليك تأين جزئياً في الماء كما بالمعادلة التالية:
– وبتطبيق قانون فعل الكتلة على الاتزان السابق كما يلي:
Ka = [CH3COO–][H+] / [CH3COOH]
[H+] = Ka [CH3COOH] / [CH3COO–] (1)
– وحيث أنه يمكن اعتبار تركيز أيون الخلات = تركيز ملح خلات الصوديوم المذابة في المحلول وذلك لصغر الكمية الناتجة عن تأين الحمض الضعيف نسبياً.
[CH3COO–] = [CH3COONa] = [salt] (2)
– كما يمكن اعتبار أن تركيز حمض الخليك في المحلول مساوياً تركيزه الشكلي وذلك لصغر الكمية المتأينة منه نسبياَ أي أن:
[CH3COOH] = [acid] (3)
– وبالتعويض بالمعادلة(2) ، (3)في المعادلة (1) نحصل على المعادلة كما يلي:
[H+] = Ka [CH3COOH] / [CH3COONa]
[H+] = Ka [acid] / [salt]
– وبأخذ اللوغاريتم السالب للطرفين كما يلي
[H+] = – log Ka – log [acid] / [salt]
pH = pKa – log [acid] / [salt]
pH = pKa + log [salt] / [acid]
– وهذه العلاقة ذات أهمية بالغة في حساب الرقم الهيدروجيني للمحاليل المنظمة المكونة من حمض ضعيف وأحد أملاحه.
(ب) حساب الرقم الهيدروجيني لمحلول منظم من قاعدة ضعيفة وأحد أملاحها
– من المحاليل المنظمة التي تتكون من قاعدة ضعيفة وأحد أملاحها محلول هيدروكسيد الأمونيوم وكلوريد الأمونيوم.
– يتأين كلوريد الأمونيوم تأيناً كاملاً عند إذابته في الماء كما بالمعادلة الآتية:
– يتأين هيدروكسيد الأمونيوم جزئياً في الماء كما بالمعادلة الآتية:
– وبتطبيق قانون فعل الكتلة على الاتزان السابق كما يلي:
Kb = [NH4+][OH–] / [NH4OH]
[OH–] = Kb [NH4OH] / [NH4+] (1)
– وحيث أنه يمكن اعتبار تركيز أيون الأمونيوم في المحلول = تركيز ملح كلوريد الصوديوم وذلك لصغر لتركيز أيونات الأمونيوم الناتجة عن تأين هيدروكسيد الأمونيوم أي أن:
[NH4+] = [NH4Cl] = [salt] (2)
– كما يمكن اعتبار أن تركيز هيدروكسيد الأمونيوم في المحلول مساوياً للتركيز الشكلي له وذلك لصغر الكمية المتأينة منه نسبياَ أي أن:
[NH4OH] = [base] (3)
– وبالتعويض بالمعادلة (2) ، (3) في المعادلة(1) نحصل على المعادلة الآتية كما يلي:
[OH–] = Kb [NH4OH] / [NH4+]
[OH–] = Kb [base] / [salt]
– وبأخذ اللوغاريتم السالب للطرفين كما يلي:
– log [OH–] = – log Kb – log [base] / [salt]
pOH = pKa – log [base] / [salt]
pOH = pKa + log [salt] / [base]
– وحيث أن:
pH = pKw – pOH
– فيكون المعادلة النهائية كما يلي:
pH = pKw – pKb – log [salt] / [base]
– وهذه العلاقة ذات أهمية بالغة في حساب الرقم الهيدروجيني للمحاليل المنظمة المكونة من قاعدة ضعيفة وأحد أملاحها.
ملخص قوانين حساب الرقم الهيدروجيني pH للمحاليل المنظمة
(1) محلول منظم مكون حامض ضعيف وأحد أملاحه
– يمكن حساب الرقم الهيدروجيني pH كما يلي:
pH = pKa + log [salt] / [acid]
(2) محلول منظم مكون قاعدة ضعيفة وأحد أملاحها.
– يمكن حساب الرقم الهيدروجيني pH كما يلي:
pH = pKw – pKb – log [salt] / [base]
موضوعات ذات صلة بالمحاليل المنظمة كما يلي:
(1) المحاليل المنظمة Buffer solutions
(2) اشتقاق قوانين pH للمحاليل المنظمة pH laws for buffer solution
المراجع:
- محاضرات الكيمياء التحليلية “التحليل الحجمى والوزني CHEM 211 . خيرية محمد عبدالله الأحمري – (1430 – 1429 هـ ) جامعة الملك عبد العزيز- المملكة العربية السعودية.
- التحليل الكيميائي الكمي التقليدي لطلاب الكليات والجامعات. محمد أحمد آشي – عبد الغني حمزة – توفيق عميرة – عبد العزيز السباعي – أحمد عشي ، الطبعة الثالثة (1418هـ – 1997 م ) – جامعة الملك عبد العزيز- المملكة العربية السعودية