عدد التأكسد – أعداد الأكسدة Oxidation Number
محتويات الموضوع
تعريف عدد التأكسد
– عدد التأكسد (عدد الأكسدة) Oxidation Number هو عدد الإلكترونات التى يمكن أن يفقدها أو تكتسبها أو تساهم بها ذرة العنصر خلال التفاعل.
– وفي المركبات التساهمية يُعرف عدد الأكسدة على أنه الشحنة التى تحملها الذرة لو حددنا إلكترونات الروابط التساهمية للذرة الأكثر سالبية كهربائية.
قواعد تحديد عدد التأكسد
– يتم تحديد عدد التأكسد حسب الخطوات الآتية كما يلي:
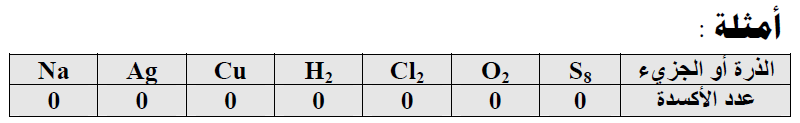
(1) عدد الأكسدة للعنصر النقي (الحر) غير المرتبط بغيره (ذرة أو جزئ) يساوي صفراً.
(2) عدد الأكسدة للايونات أحادية الذرة يساوي شحنتها.
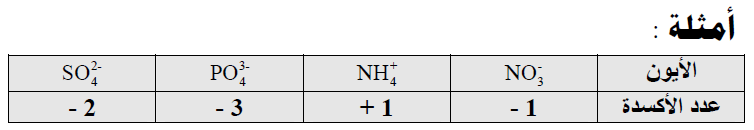
(3) مجموع أعداد الأكسدة لجميع الذرات في ايون يجب أن تساوي الشحنة الموجودة على ذلك الأيون.
(4) مجموع أعداد الأكسدة لجميع الذرات فى مركب متعادل (لا يحمل شحنة) يساوي صفراً.
(5) عدد الأكسدة للهيدروجين في جميع مركباته هو (+1) باستثناء هيدريدات الفلزات كما يلي: هيدريد الصوديوم (NaH) وهيدريد الكالسيوم (CaH2) فإن عدد الأكسدة له (-1).
(6) عدد الأكسدة للأكسجين فى جميع مركباته (-2) ماعدا :-
(أ) مركبات فوق الأكسيد مثل فوق أكسيد الهيدروجين (H2O2) وفوق أكسيد الصوديوم (Na2O2) وفوق أكسيد البوتاسيوم (K2O2) وفوق أكسيد الكالسيوم (CaO2) فأن عدد الأكسدة للأكسجين فيها يساوي (-1).
(ب) مركب فلوريد الأكسجين (OF2) عدد الأكسدة للأكسجين فيه هو (+2) لأن السالبية الكهربائية للفلور أعلى من الأكسجين.
(جـ) مركب سوبر أكسيد البوتاسيوم (KO2) عدد الأكسدة للأكسجين فية هو (1/2-) .
(7) عدد الأكسدة لعناصر المجموعة الفلزية (1A) (الفلزات القوية ) في مركباته تساوي (+1).
– ومن أمثلة الفلزات القلوية كما يلي: ( Rb – K – Na – Li)
(8) عدد الأكسدة لعناصر المجموعة السابعة ( الهالوجينات) غالباً تساوي (-1)
– ومن أمثلة الهالوجينات كما يلي : (F – Cl – Br – I).
– أما إذا ارتبط الهالوجين بذرات ذات سالبية كهربية أعلى منه مثل الأكسجين فإن عدد أكسدة الهالوجين سوف يأخذ عدد أكسدة موجب مثل:
Cl2O عدد أكسدة الكلور = +1 ، HClO3 عدد أكسدة الكلور = +5
مسائل محلولة على حساب عدد الأكسدة
المثال التالي يوضح حساب عدد التأكسد لبعض المركبات كما يلي:
أكمل باقي التمرين بنفس الطريقة لحساب عدد التأكسد للمركبات الأخرى.