الكيمياء الكهربية – مصطلحات الكيمياء الكهربية
محتويات الموضوع
الكيمياء الكهربية Electrochemistry
– الكيمياء الكهربية هو ذلك الفرع من الكيمياء الفيزيائية الذى يهتم بدراسة:
- التحولات الكيميائية الناتجة عن مرور التيار الكهربي (خلايا التحليل الكهربي).
- إنتاج الكهرباء عن طريق التحولات الكيميائية (الخلايا الجلفانية).
كما يمكنك الدخول الى قسم الكيمياء الكهربية فى موقعنا لرؤية الموضوعات المتعلقة الأخرى ولكن الآن دعونا نتطرق إلى بعض المفاهيم الأساسية والمصطحات فى الكيمياء الكهربية.
 |
الأكسدة Oxidation
– الأكسدة ھي فقد العنصر إلكتروناً أو أكثر أو ھي الزيادة في عدد الأكسدة.
الاختزال Reduction
– الاختزال ھو اكتساب العنصر إلكترونا أو أكثر أو ھو النقص في عدد الأكسدة.
العامل المؤكسد (Oxidizing agent)
– ھو المادة التي تؤكسد مادة أخرى تتفاعل معھا ، وتحدث لھا عملية اختزال (تكتسب إلكترونا أو أكثر).
العامل المختزل (Reducing agent)
– ھو المادة التى تختزل مادة أخرى تتفاعل معھا ، وتحدث لھا عملية أكسدة (تفقد إلكترونا أو أكثر).
عدد الأكسدة ((Oxidation Number
– ھو عدد الإلكترونات التي يمكن أن تفقدها أو تكتسبها أو تساھم بھا ذرة العنصر خلال التفاعل.
المصعد Anode
– المصعد ھو القطب الذي يحدث له أكسدة (تآكل) إن كان نشطا مثل الخارصين ، النحاس ، الكادميوم.
– أو ھوالقطب الذي تحدث على سطحه أكسدة الأصناف الموجودة فى المحلول أن كان خاملاً.
– ومن أمثلة الأقطاب الخاملةالبلاتين Pt ، الذهب Au
– ومن أمثلة الأصناف في المحلول التي يمكنھا أن تتأكسد :
- الأيونات السالبة مثل –I–، Cl
- جزئيات الماء H2O
– وفى الغالب فأن أقطاب المصعد النشطة تستخدم فى الخلايا الجلفانية بينما أقطاب المصعد الخاملة تستخدم فى خلايا التحليل الكهربي.
المهبط Cathode
– هو القطب الذى يحث على سطحه الاختزال ويكون دوره فقط هو التوصيل الكهربائي.
القنطرة الملحية Salt bridge
– القنطرة الملحية هي أنبوبة زجاجية أو بلاستيكية مفتوحة الطرفين على شكل حرف (U).
– تملأ بمحلول مشبع من ملح كلوريد البوتاسيوم (KCl) ، أو كبريتات البوتاسيوم K2SO4)) أو نترات البوتاسيوم KNO3 أو غيرھا.
– وبعد ملئھا ينبغي التأكد أنه لا توجد فقاعات ھوائية داخل المحلول الذي بھا، فإن وجد يسكب محتواھا ويعاد ملؤھا من جديد.
– وبعد ملئھا بالمحلول تسد فتحتاھا بسدادة من قطن أو مناديل ورقية ثم تنكس ويوضع كل طرف منھا في محلول من محاليل الخلية الجلفانية.
تفاعلات الأكسدة والاختزال
– تفاعلات الأكسدة والاختزال هي نوع من التفاعلات الكيميائية التي تنتقل فيها الإلكترونات من أحد المواد المتفاعلة إلى الأخرى الداخلة معها في التفاعل.
موصلات إلكتروليتية
– مواد توصل التيار الكهربي عن طريق حركة أيوناتها مثل محاليل الأحماض.
موصلات إلكترونية
– مواد توصل التيار الكهربي من خلال إلكتروناتها مثل الفلزات.
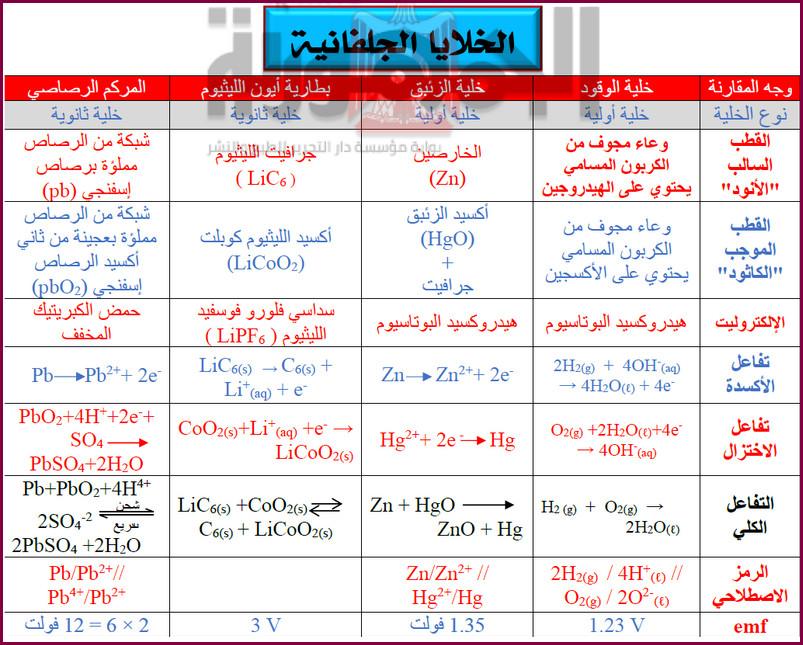
الخلايا الجلفانية
– الخلايا الجلفانية هي خلايا يتم فيها تحويل الطاقة الكيميائية إلى طاقة کهربية من خلال تفاعل أكسدة واختزال تلقائي.
قطب العنصر
– هو العنصر مغمور في أحد أملاحه
قطب النحاس
– ساق نحاس مغمور في محلول أحد أملاحه (مثل محلول كبريتات النحاس).
قطب الخارصين
– ساق خارصين مغمور في محلول أحد أملاحه (مثل محلول كبريتات الخارصين).
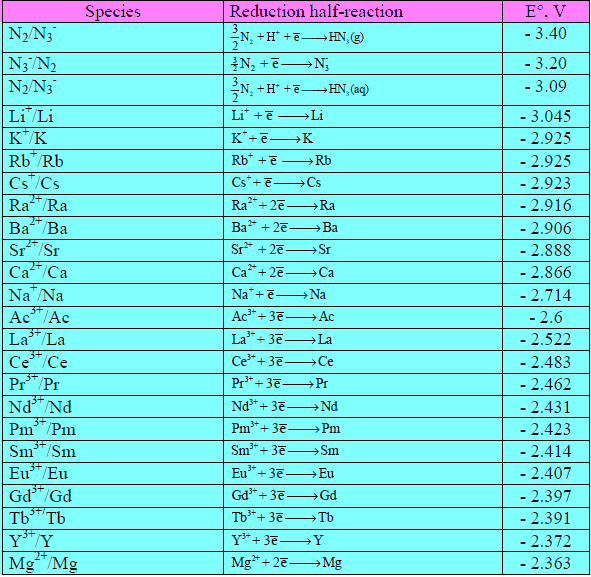
سلسلة الجهود الكهربية
– هو ترتيب تنازلي للعناصر حسب جهود تأكسدها القياسية مع الهيدروجين.
– أو ترتيب تصاعدى للعناصر حسب جهود اختزالها القياسية مع الهيدروجين.
قطب الهيدروجين
– هو قطب قياسى جهده يساوی صفر (S.H.E)
– هو عبارة عن صفيحة من البلاتين مغطاه بطبقة أسفنجية من البلاتين الأسود يمرر عليها تيار من غاز الهيدروجين تحت ضغط واحد جوى ومغمور فى محلول واحد مولار 1M من أى حمض قوى.
الخلايا الأولية
– أنظمة تختزن الطاقة في صورة طاقة كيميائية والتي يمكن تحويلها عند اللزوم إلى طاقة كهربية من خلال تفاعل أكسدة واختزال تلقائی غیر انعکاسی
خلية الزئبق
– خلية صغيرة الحجم في شكل اسطواني أو قرص شائعة الاستخدام في سماعات الأذن والساعات.
الخلايا الثانوية
– خلايا جلفانية تتميز بأن تفاعلاتها الكيميائية انعكاسية (يمكن إعادة شحنها) وتختزن الطاقة الكهربية على هيئة طاقة كيميائية.
إعادة شحن البطارية
– توصيل قطبى البطارية بمصدر تيار كهربى مستمر له جهد أكبر قليلاً من جهد البطارية مما يؤدى إلى حدوث تفاعل عكس التفاعل التلقائي.
الهيدروميتر
– يستخدم الهيدروميتر لقياس كثافة السوائل مثل محلول الحمض في بطارية السيارة.
الدينامو
– يعمل الدينامو على إعادة شحن بطارية السيارة أولاً بأول.
الصدأ
– هو تأكل الفلزات بفعل الوسط المحيط.
الجلفنة
– غمس الحديد فى الخارصين المنصهر الحمايته من التآكل.
الحماية الكاثودية (الغطاء الكاثودي)
– يكون فيها الفلز الواقى أقل نشاط من الفلز الأصلى (تغطية الحديد بطبقة من القصدير)
الحماية الأنودية (الغطاء الأنودي)
– يكون فيها الفلز الواقى أكثر نشاطاً من الفلز الأصلى( تغطية الحديد بطبقة من الخارصين)
القصدير
– فلز يستخدم فى وقاية الحديد المستخدم في علب المأكولات المعدنية.
القطب المضحي
– هو فلز أكثر نشاطاً مثل الماغنسيوم يتم توصيله بأسطوانات الحديد حيث يعمل الماغنسيوم كأنود ويعمل الحديد كاثود.
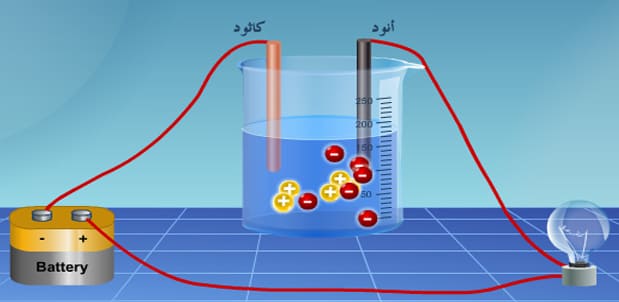
الخلايا الإلكتروليتية
– خلايا كهربية تستخدم فيها الطاقة من مصدر خارجي لإحداث تفاعل أكسدة واختزال غير تلقائي الحدوث.
الكريوليت
– هي مادة تستخدم كمذيب للبوكسيت عند استخلاص فلز الألومنيوم في الصناعة.
التحليل الكهربي
– عملية فصل مكونات محلول أو مصهور إلكتروليتى بإمرار تيار كهربي خلاله.
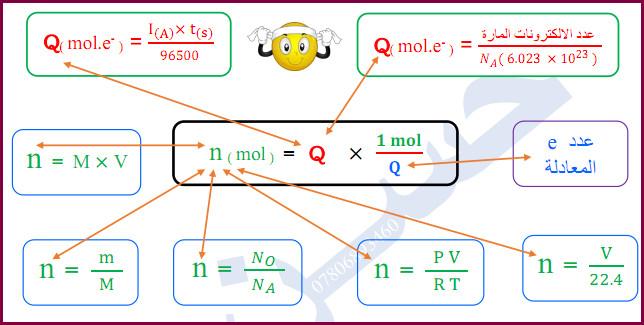
الكولوم
– هو كمية الكهربية الناتجة من مرور تيار شدته واحد امبير لمدة ثانية واحدة
– الكولوم = شدة التيار بالأمبير × الزمن
– أو هو كمية الكهرباء التى ترسب 1.118mg من الفضة عند مرورها في محلول أيونات الفضة.
الفانون الأول لفاراداي
– تتناسب كمية المادة المتكونة أو المستهلكة عند أى قطب سواء كانت غازية أو صلبة تناسباً طردياً مع كمية الكهربية التى تمر فى المحلول الإلكتروليتي.
القانون الثاني لفاراداي
– كتلة المواد المختلفة المتكونة أو المستهلكة بمرور نفس كمية الكهرباء تتناسب مع كتلتها المكافئة.
الكتلة المكافئة الجرامية
– كتلة المادة التي لها القدرة على فقد أو اكتساب مول واحد من الإلكترونات أثناء التفاعل الكيميائي.
الفاراداي
– هو كمية الكهربية اللازمة لذوبان أو تصاعد أو ترسيب كتلة مكافئة جرامية من المادة عند أحد الأقطاب بالتحليل الكهربى يساوى 96500 كولوم
القانون العام للتحليل الكهربي
– عند إمرار واحد فارادای (96500) کولوم خلال إلكتروليت فإن ذلك يؤدى إلى ذوبان أو ترسيب أو تصاعد الكتلة المكافئة الجرامية لأى عنصر عند أحد الأقطاب.
الطلاء بالكهرباء
– هي عملية تكوين طبقة رقيقة من فلز معين على سطح فلز آخر لحمايته من التآكل.
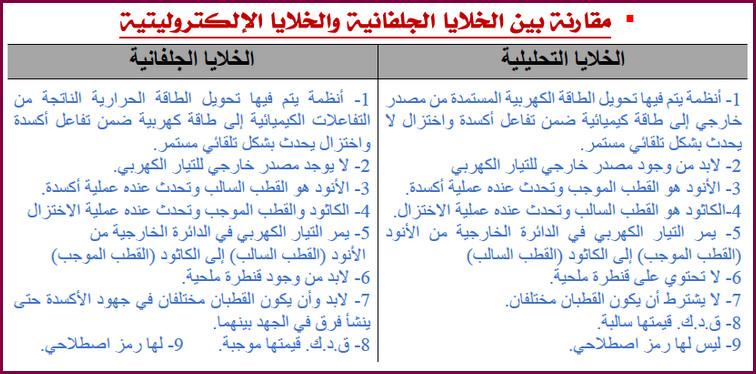
مقارنة بين الخلية الجلفانية والخلية الإلكتروليتية
– الجدول التالي يبين مقارنة بين الخلية الجلفانية والخلية الإلكتروليتية كما يلي:
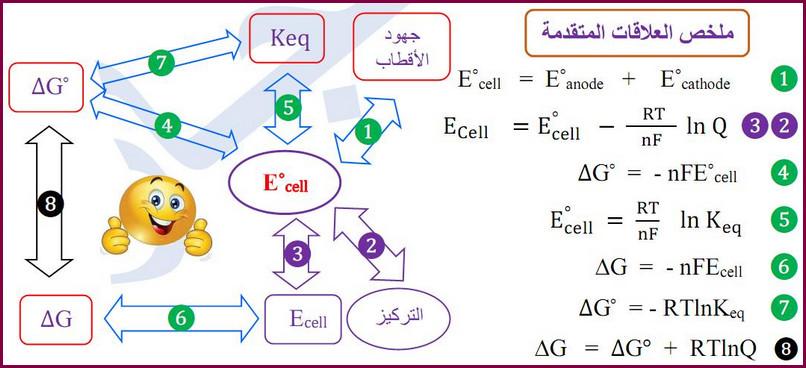
قوانين هامة فى الكيمياء الكهربية
– الصور التالية تيبين القوانين الهامة فى الكيمياء الكهربية كما يلي:
– لمشاهدة ملحق لأهم لتفاعلات الأكسدة والأختزال فى الكيمياء الكهربية أضغط هنا