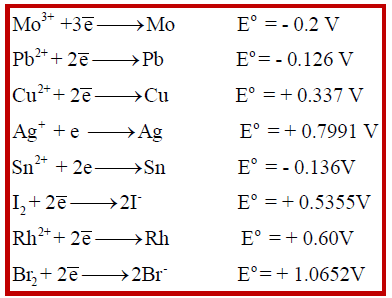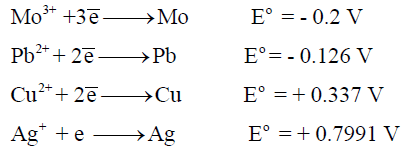القدرة على الأكسدة والأختزال عن طريق قياس القوة الدافعة الكهربية
– في هذا الموضوع سيتم مناقشة موضوع القدرة على الأكسدة والأختزال عن طريق قياسات القوة الدافعة الكهربية.
محتويات الموضوع
التطبيقات العملية لقياسات القوة الدافعة الكهربية
– من أهم التطبيقات العملية لقياسات القوة الدافعة الكهربية وهى كما يلي:
(1) ترتيب العوامل المؤكسدة والمختزلة من حيث قدرتها على الأكسدة والأختزال.
(2) إختيار عامل مؤكسد (أو مختزل) لمادة واحدة.
وسوف نتناول كلاً منهم بالتفصيل.

ترتيب العوامل المختزلة أو المؤكسدة حسب قدرتها على الأكسدة والأختزال
مثال (1)
رتب المواد التالية من حيث:
(أ) قدرتھا على الإختزال
(H2 , Mn , Cl– , Zn)
(ب) قدرتھا على الأكسدة
(2+H+ , Mn2+ , Cl2 , Zn)

الحل : بترتيب قيم جھود الاختزال تصاعدياً
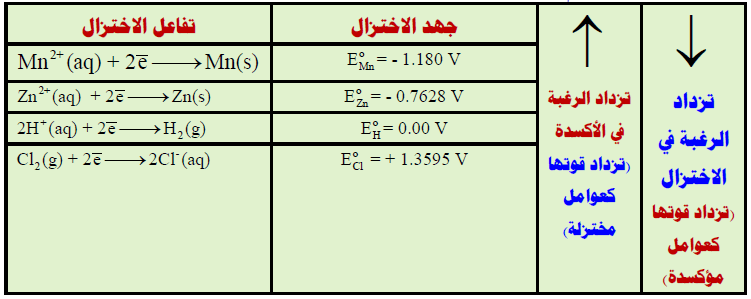
ومنه يتضح كما يلي :
(1) جزئيات الكلور (Cl2) له أعلى جهد اختزال وبالتالي فهو قادر على أكسدة كل من (H2, Zn, Mn) يليه أيونات الهيدروجين القادرة على أكسدة (Zn, Mn) ولكنه لا يقدر على أكسدة –Cl ، يليه أيونات (2+Zn) القادر فقط على أكسدة (Mn) ولا يقدر على أكسدة ( –H2, Cl).
(2) المنجنيز (Mn) قادر على اختزال كل من (Zn2+ , H+ , Cl2)
– أما (Zn) فهو قادر على اختزال (H+, Cl2) لكنه غير قادر على اختزال (2+Mn)
– أما (H2) فهو قادر على اختزال الكلور فقط (Cl2) فقط.
– ولكن (–Cl) فليس لدية القدرة على اختزال أى من المواد (Zn2+ , H+ , Cl2).
إختيار عامل مؤكسد (أو مختزل) لمادة واحدة
حينما توجد عدة مواد يُراد اختزال (أو أكسدة) أحدهما دون الأخرى فأنه يمكن الاستعانة بالسلسلة الكهروكيميائية لتحقيق ذلك.
مثال (2)
أي المواد التالية:
(أ) يختزل (Ag+) ولا يختزل (Pb2+) ، النحاس (Cu) أو المولبدينيوم (Mo)؟
(ب) يؤكسد (Sn) ولا يؤكسد (Rh) ، اليود (I2) أم البروم (Br2 )؟
علماً بأن جھود الإختزال كما يلي:
الحل:
(أ) وفقاً لجھود الاختزال:
– فإن كلاً المعدنين (النحاس (Cu) أو المولبدينيوم (Mo)) يستطيعان اختزال أيونات الفضة لأن جهد اختزالهما أكثر سالبية.
– بينما النحاس يختزل أيونات الفضة (لأن جھده أكثر سالبية) ولا يختزل أيونات الرصاص (لأن جھده أكثر إيجابية).
(ب) وفقاً لجھود الاختزال:
– فإن البروم يؤكسد كلاً من القصدير (Sn) و (Rh) لأن جهد اختزال البروم أكثر إيجابية منهما.
– في حين أن اليود (I2) يؤكسد القصدير ( لأن جهد اختزال اليود أكثر إيجابية ) بينما لا يؤكسد الروديوم (Rh) لأن جھد اختزال اليود أكثر سالبية.
المراجع : الفصل الرابع عشر – التطبيقات العملية بإستخدم قياسات القوة الدافعة الكهربية – من كتاب أسس ومبادئ الكيمياء الكهربية الجزء الثاني للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء – كلية العلوم التطبيقية – جامعة أم القرى.