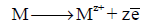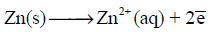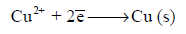جهود الأقطاب المفردة Single Electrode في الخلية الجلفانية
– من المعروف أن التیار الكھربي لا ینتقل من نقطة الى أخرى إلا إذا كان ھناك فرق جھد بین نقطتین. لذلك فمن البدیھي إذاً أنه لابد من وجود فرق جھد بین القطبین في أي خلیة جلفانیة حیث أن ھذا الفرق في الجھد في الحقیقة
ھو القوة الدافعة الكھربیة للخلیة.
– نظراً لأن القوة الدافعة الكھربیة تختلف من خلیة لأخرى فقد استنتج العالم (نیرنست) أن لكل قطب جھد معین یعرف بجھد القطب.
– یتوقف جهد القطب على نوع الفلز وتركیز المحلول.
الجهد القطبي ومنشأه Origin of Potential Electrode
– الاتزان بين المعدن وأيوناته في المحلول يشبه الاتزان بين السائل وبخاره.
– فعند درجة الحرارة معينة نجد أن السائل له ضغط بخاري معين. وهو ضغط البخار المتزن مع السائل عند نفس درجة الحرارة
– فإذا زاد الضغط البخاري عن ضغط الاتزان (equilibrium pressure) نجد أن الجزيئات تهرب من البخار إلى السائل حتى يحدث الاتزان.
– وإذا قل ضغط البخار يحدث العكس أي ان الجزيئات تهرب من السائل وتتحول إلى البخار حتى يحدث الاتزان.
– وسنقارن هذا السلوك بالنسبة للمعادن النشطة والأقل نشاطاً المغمورة في محاليلها.
أولاً: العناصر النشطة active metals
– نجد نفس الشيء بالنسبة للعناصر النشطة مثل (Na, K, Zn, Fe) حيث أن الذرات أقل ترابطاً مع بعضها البعض وعندها القابلية للهروب إلى المحلول في صورة أيونات موجبة (Positive ions).
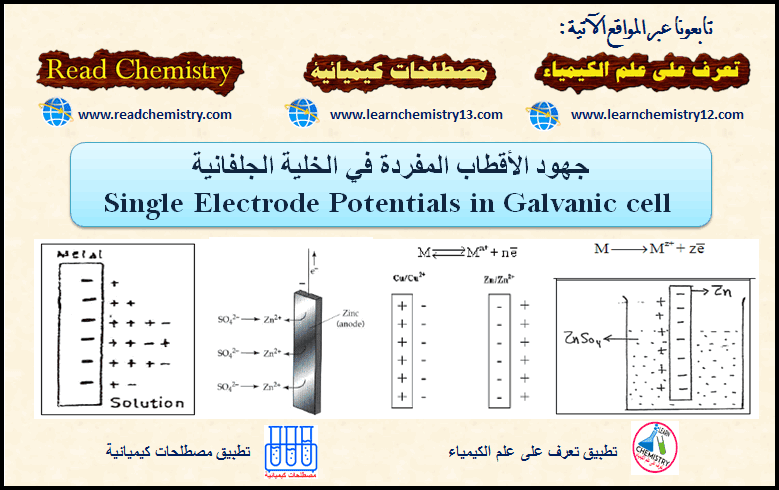
– طبقاً لهذا إذا وضع أي من المعادن السابقة في محلول أيوناته، نجد تكون شحنات سالبة على المعدن نتيجة لتراكم الإلكترونات.
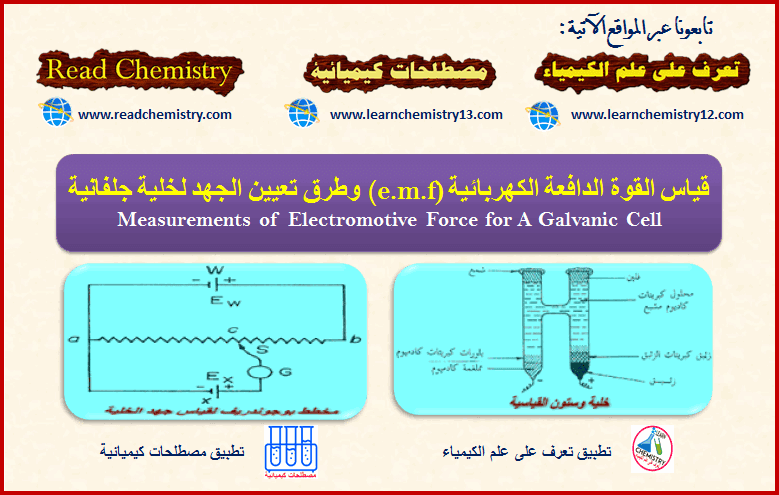
– ومن الناحية الأخرى نجد أن المحلول يحتوى على شحنات موجبة، ونجد تكون طبقة مزدوجة electrical double layer كما هو موضح بالشكل (1) في حالة غمس قطب الخارصين في محلول أيوناته. أو بالشكل (2) في حالة غمس قطب (M) في محلول أيوناته. ويتكون مجال كهربائي نتيجة ذوبان المعدن:
 |
| شكل (1) |
ثانياً: العناصر الأقل نشاطاً less active metals
– في حالة العناصر الأقل نشاطاً مثل الذهب Au ، الفضة Ag ، النحاس Cu …. الخ) نجد أن الذرات مرتبطة ارتباطاً قوياً مع بعضها ولذلك لها قابلية اقل للهروب إلى المحلول في صورة أيونات موجبة.
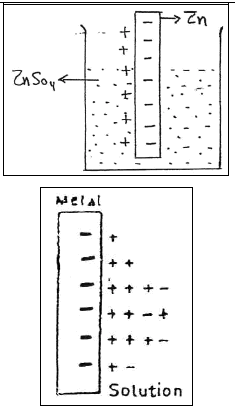
– ونجد الأيونات الموجودة في المحلول لها قابلية للهروب من المحلول وتترسب على المعدن وتتكون طبقة مزدوجة من الشحنات الموجبة والسالبة بين المحلول والمعدن.
الخلاصة
– ويمكن شرح السلوك السابق على أساس الشبكة البلورية لأى فلز تتكون من أيونات هذا الفلز وإلكتروناته الحرة الحركة وطبقاً لذلك يكون لأيونات هذا الفلز مايسمى بالجهد الكيميائي Potential Chemical في القطب أو في المحلول.
– وعليه فإن: أيونات الفلز تمر من طبقة القطب إلى المحلول إذا كان الجهد الكيميائي لأيوناته في طبقة القطب أكبر من الجهد الكيميائي لأيونات هذا الفلز في المحلول.
– وعلى هذا الأساس تتكون طبقة كهربائية مزدوجة electrical double layer بين سطح القطب والمحلول. وبذلك ينشأ فرق جهد عبر هذه الطبقة الكهربائية ويعرف باسم جهد القطب electrode potential
– تعتمد إشارة جهد القطب على الفرق بين الجهد الكيميائي لأيونات الفلز في كل طبقة القطب والمحلول.
مثال توضيحي
عند عمل خلية جلفانية مؤلفة من قطبي الخارصين والنحاس كل منهما مغمور في محلول أيوناته (كبريتات خارصين
، كبريتات نحاس) ووصل بينهما بدائرة خارجية وبين محاليلهما بقنطرة ملحية فإنه يلاحظ الآتي:
(1) بسبب أن الجهد الكيميائي لأيونات الخارصين في الشبكة البلورية أكبر من الجهد الكيميائي لأيونات الخارصين في المحلول:
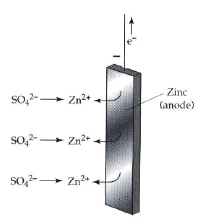
فإن أيونات الخارصين تمر من سطح القطب غلى المحلول تاركة طبقة من الإلكترونات على سطح القطب ويكون التفاعل الحادث هو:
وبذلك تنشأ طبقة كهربائية مزدوجة من الإلكترونات على سطح القطب وايونات الخارصين الموجبة في المحلول والقريبة من سطح القطب. ويكون فرق الجهد الناشئ عبر هذه الطبقة هو جهد قطب الخارصين ويكون سالباً. (انظر الشكل 1)
(2) بسبب أن الجهد الكيميائي لأيونات النحاس في المحلول أكبر من الجهد الكيميائي لأيونات النحاس في الشبكة البلورية:
فإن أيونات النحاس تتجه إلى سطح قطب النحاس لتتفاعل مع الإلكترونات على سطحه. ويترسب النحاس الأيوني على سطح القطب على هيئة ذرات متعادلة على سطح القطب.
وبذلك تنشأ الطبقة الكهربائية المزدوجة ، وتتكون طبقة موجبة من أيونات النحاس على سطحه وطبقة من الإلكترونات القريبة من سطح القطب في المحلول. ويكون فرق الجهد الناشئ عبر هذه الطبقة هو جهد قطب النحاس ويكون موجباً.
– يتضح مما سبق أنه:
عند غمر قطب من فلز ما في محلول أيوناته (مثل غمر معدن النحاس في محلول يحوي أيونات النحاس ، او غمر معدن الخارصين في محلول يحوي ايونات الخارصين) فأننا نجد أتزاناً بين المحلول والمعدن بسبب أن فرق جهد ينشأ على السطح الفاصل بين القطب ومحلوله metal/solution interface ، وبهذه الطريقة نجد أن المعدن يستخدم كقطب (electrode) وقيمة الجهد الناتج يسمى بجهد القطب Potential electrode وقيمة الجهد تعتمد على المعدن المستخدم وتركيز أيونات المحلول.
أسئلة توضيحية
س1: كیف ینشأ جھد القطب ؟
ج1: أوضح نرنست كیف ینشأ جھد القطب كما یلي:
عند وضع فلز ما في محلول یحتوي على أیوناته فإن الفلز یمیل الى الذوبان في المحلول، وفي نفس الوقت تمیل أیونات الفلز الموجودة في المحلول الى الترسب على سطح الفلز، وسرعان ما تنشأ حالة اتزان بین الفلز والمحلول عندما یتساوى عدد الأیونات التي تترك سطح الفلز في الثانیة مع عدد الأیونات التي تترسب علیه.
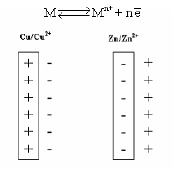
ویكون تمثیل ھذا الإتزان في حالة قطب الخارصين المغمور في محلول كبريتات الخارصين وقطب نحاس مغمور في محلول أيونات نحاس (شكل 2) كالآتي:
 |
| شكل (2) |
(1) فإذا كان میل ذرات الفلز الى التأین یفوق میل أیوناته للتحول الى ذرات، كما في حالة · الخارصین الملامس لمحلول كبریتات الخارصین، فنجد أن بعضاً من أیونات الفلز تنفصل عنه وتتجه الى المحلول. وبذلك یكتسب الفلز شحنة سالبة نتیجة لتراكم بعض الأیونات علیه كما یكتسب المحلول شحنة موجبة نتیجة لانتشار بعض الأیونات علیه. ونتیجة لاختلاف الشحنة بین الفلز والمحلول ینشأ فرق جھد ویكون القطب في ھذه الحالة ھو القطب السالب للخلیة.(شكل 3)
 |
| شكل (3) |
(2) أما إذا كان میل أیونات الفلز للتحول الى ذرات یفوق میل ذراته للتحول الى أیونات· كما في حالة قطب النحاس
الملامس لمحلول كبریتات النحاس، فنجد أن بعض أیونات المحلول تترسب على سطحه فیكتسب شحنة موجبة، بینما یكتسب المحلول شحنة سالبة ویكون القطب في ھذه الحالة القطب الموجب للخلیة.
س2: ھل یمكن قیاس جھد القطب المفرد (المطلق)؟
ج2: لا یمكن قیاسه تجریبیاً، ولكن یمكن قیاس الفرق في الجھد بین القطبین المكونین للخلیة.
س3: كیف یتم قیاس جھود الأقطاب؟
ج3: لتعيين جهد أي قطب ما فأنه لا بد من إدماجه في خلية مع قطب آخر يكون جهده صفراً (قطب قياسي اختياري بحيث يكون قطباً مرجعاً reference electrode تقارن به جهود الاقطاب المختلفة) وبالتالي فإن القوة الدافعة الكهربائية لهذة الخلية تساوي جهد هذا القطب.
ولأنه لا يوجد قطب ذو جهد حقيقي يساوي صفراً ، لذلك اصطلح عالمياً على اعتبار أن جهد قطب الهيدروجين القياسي يساوي صفراً عند جميع درجات الحرارة المختلفة ونسبت إليه جميع جهود الأقطاب. ولقد أخد قطب الهيدروجين hydrogen electrode على أنه القطب المرجع.
المراجع: كتاب الكيمياء الكهربائية / د.عمر بن عبدالله الهزازي/ قسم الكيمياء-كلية العلوم التطبيقية – جامعة أم القرى/ المملكة العربية السعودية