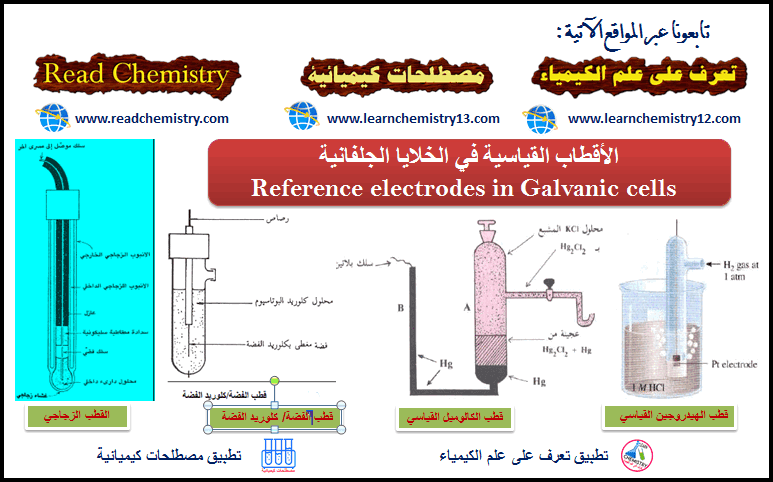
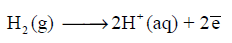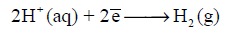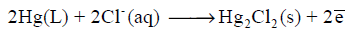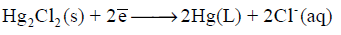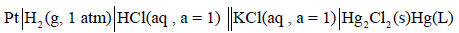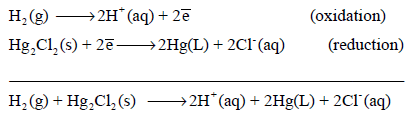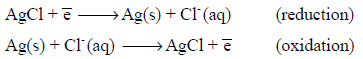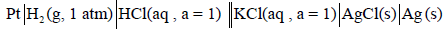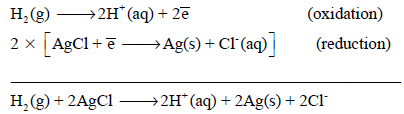الأقطاب القياسية في الخلايا الجلفانية Reference electrodes in Galvanic cells
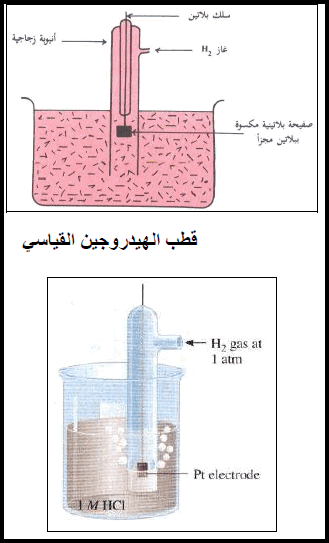
قطب الهيدروجين القياسي eStandard Hydrogen electrod
اتفق أو اصطلح على اتخاذ ما يعرف بقطب الهيدروجين القياسي القياسي ويرمز له بالرمز (SHE) ليكون هو القطب التى تقاس بالنسبة لجهده جهود بقية الأقطاب وقد أعطي جهده قيمة افتراضية هي صفر فولت.
وصف قطب الهيدروجين القياسي
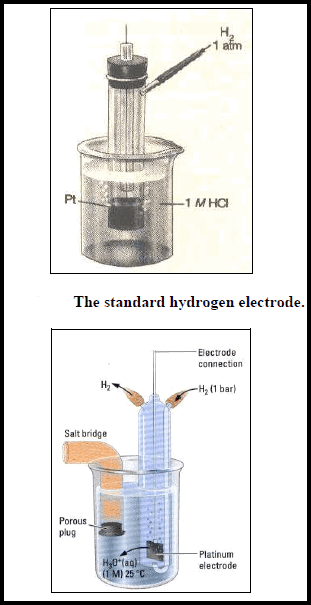
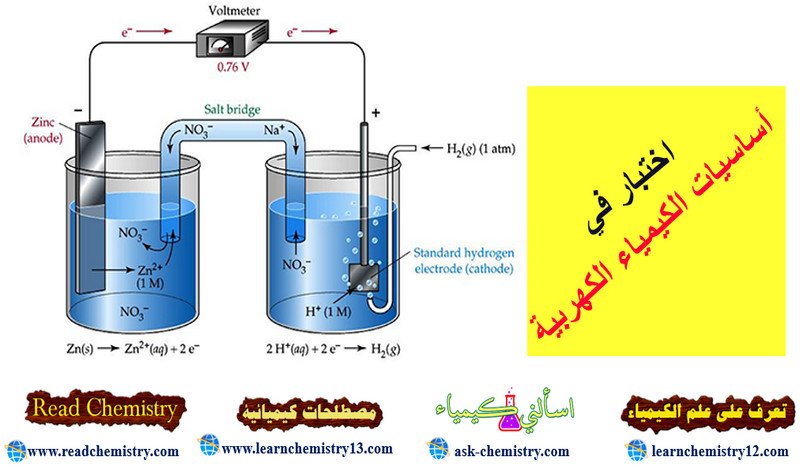
– یتكون قطب الھیدروجین (الأشكال الآتية) من قطعة من البلاتین على ھیئة صفیحة مكسوة ببلاتین مجزأ وتحاط بغاز الھیدروجین ومغمورة في محلول یحتوي على أیونات الهيدروجين (H+) مثل محلول حمض الكلور .(HCl)
– ویوصف قطب الھیدروجین بأنه قطب قیاسي standard electrode إذا كان ضغط الغاز یساوي ضغط جوي واحد (1 atm) عند 25 Co وفعالیة أیونات الھیدروجین تساوي مولاً واحداً، وذلك عند جمیع درجات الحرارة. ولقد اتفق على أن یعطى جھد الإختزال القیاسي له قیمة تساوي صفراً.
قياس الجهد باستخدام قطب الهيدروجين القياسي
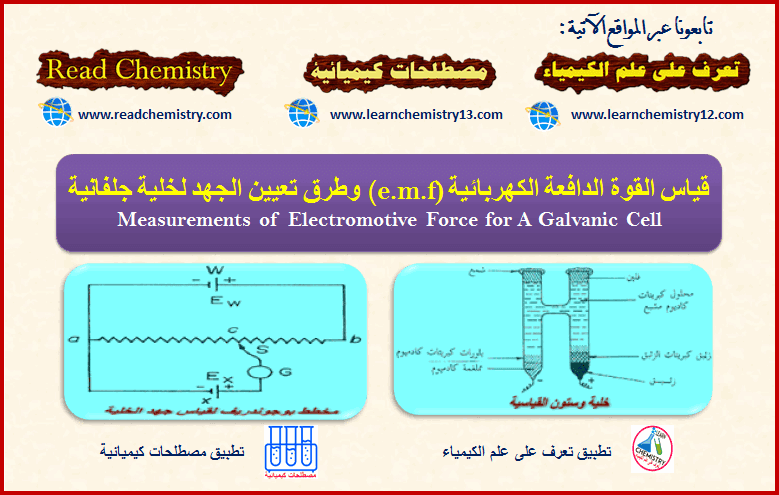
– يمكن قياس جهد أى قطب غير معلومة قيمته بتكوين خلية من هذا القطب مع قطب الهيدروجين القياسي ثم قياس قيمة القوة الدافعة الكهربائية (e.m.f) لهذة الخلية.
– حيث أن قيمة جهد قب الهيدروجين القياسي تساوي الصفر ، فعلى ذلك فإن قيمة (e.m.f) تساوي قيمة جهد القطب الغير المعلومة قيمته، وتسمى هذه القيمة بالجهد النسبي لهذا القطب relative electrode potential
تفاعلات الأكسدة والاختزال لقطب الهيدروجين
– تفاعل الأكسدة لقطب الھیدروجین:
– تفاعل الإختزال لقطب الھیدروجین:
الأقطاب القياسية الثانوية secondary reference electrodes
– مع ذلك فإن ھناك أقطاباً قیاسیة أخرى تستخدم بدلاً من قطب الھیدروجین تعرف بالأقطاب المرجعیة (القیاسیة) الثانویة في كثیر من الأحیان ، فلماذا؟
– یعود سبب استبدال قطب الھیدروجین بھذه الأقطاب القیاسیة الثانویة بسبب عيوبه المتمثلة في الآتي:
(1) صعوبات تواجه تحضیر واستعمال قطب الھیدروجین القیاسي. ·
(2) حساسیة قطب الھیدروجین للشوائب أياً كانت.
(3) تأثر جھده حیث أن جھده غیر ثابت مع مرور الزمن. وبالتالي لا يمكن الاحتفاظ به مدة طويلة بدون تغير في قيمة جهده. ومن أهم الصفات التى ينبغي أن يتصف بها القطب القياسي أن يكون ذا جهد ثابت.
– بسبب الصعوبات التى تنشأ من تحضير واستعمال قطب الهيدروجين ، استخدمت انواع أخرى من الأقطاب أكثر حساسية ودقة بالمقارنة مع قطب الهيدروجين سميت بالاقطاب الثانوية Secondary Electrodes
– والأقطاب المرجعیة الثانویة قیست جھودھا الإختزالیة نسبة الى قطب الھیدروجین (عينت جهودها بمعايرتها بقطب الهيدروجين) كما ھو حال بقیة الأقطاب في جداول السلسلة الكھروكیمیائیة.
– من أمثلة ھذه الأقطاب الثانویة القیاسیة:
(1) قطب الكالومیل القياسي (Calomel Electrode).
(2) قطب الفضة – كلورید الفضة
(3) القطب الزجاجي glass electrode والمستخدم في جھاز مقیاس الحموضة pH meter
(4) قطب الكوينهيدرون القياسي لقياس pH للمحاليل.
الشروط اللازم توافرها في الأقطاب القياسية الثانوية
من أهم الشروط الواجب توافرها في الأقطاب القياسية الثانوية:
(1) أن يكون ذا جهد ثابت لا يتأثر بالوقت ولا بدرجة الحرارة.
(2) أن لا يكون قابلاً للإستقطاب (أو على الأقل أن يكون أقل استقطاباً (لا تحدث تفاعلات جانبية على سطحه تغير من قيمة جهده)
(3) أن يكون تفاعل القطب عكسياً.
(4) ان يكون القطب سهل التحضير.
هناك أقطاب قياسية ثانوية كثيرة تمتاز بمميزات أفضل مما يتميز به قطب الهيدروجين القياسي ومنها:
(1) سهولة التصميم
(2) انخفاض التكلفة
(3) عدم تغير الجهد بمرور الوقت.
(4) عدم استعمال غاز الهيدروجين القابل للإشتعال.
أولاً: قطب الكالوميل القياسي Calomel Reference Electrode
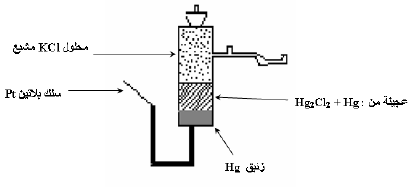
– الكالوميل هو كلوريد الزئبق الأحادي (Hg2Cl2) وهذا القطب تكون من زئبق بحالة تماس مع الكالوميل مغموراً في محلول يحتوي على أيونات الكلوريد (عادة محلول كلوريد البوتاسيوم).
– يمكن تمثيل الترميز لهذا القطب كما يلي:
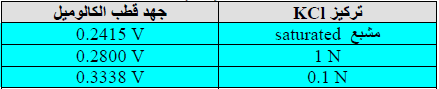
– يستخدم قطب الكالوميل كقطب قياسي لتعيين قيمة الجهد لأى قطب آخر غير معلوم جهده. وتعتمد قيمة جهد قطب الكالوميل على تركيز كلوريد البوتاسيوم KCl (تركيز ايون الكلوريد Cl–) الموجود في الإناء الزجاجي.
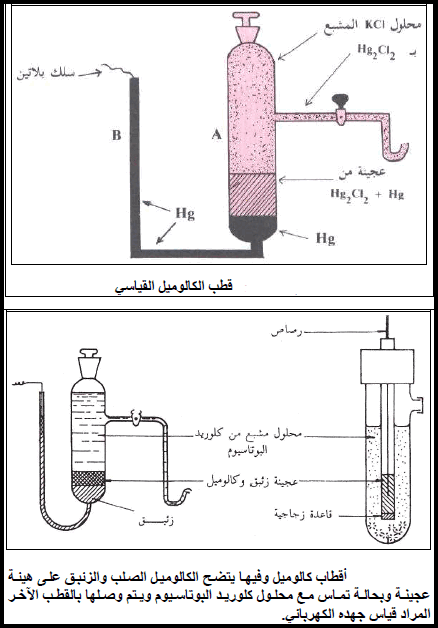
تركيب قطب الكالوميل
– يتألف قطب الكالوميل كما في الأشكال الآتية من الزئبق المغطى بطبقة رقيقة من عجينة من الزئبق (Hg) وكلوريد الزئبقوز (Hg2Cl2) ثم يملأ بعد ذلك بمحلول كلوريد البوتاسيوم KCl (المشبع مثلاً) الذي يعلو العجينة. ويتصل بهذة المكونات سلك بلاتين للتوصيل.
– هناك ثلاثة تراكيز لمحلول كلوريد البوتاسيوم KCl يكون قطب الكالوميل القياسي ذا جهد ثابت عندها وهي:
(KCl saturated, KCl (1 mol/L), KCl (0.1 mol/L)
وطبقاً لتركيز كلوريد البوتاسيوم فإنه توجد ثلاثة اقطاب قياسية من الكالوميل كل منهم ذات جهد مختلف عن الآخر عند درجة حرارة ثابتة.
– الجدول التالي يبين قيمة جهد قطب الكالوميل عند تراكيز مختلفة من ايون الكلوريد عند درجة حرارة 25 Co:
تفاعلات الأكسدة والاختزال لقطب الكالوميل
– عندما يكون قطب الكالوميل مصعداً يحدث له تفاعل الأكسدة التالي:
– عندما يكون قطب الكالوميل مهبطاً يحدث له تفاعل الإختزال التالي:
– يعين جهد هذا القطب بتوصيله بقطب الهيدروجين وعمل خلية من هذين القطبين:
– تفاعلات الأكسدة والاختزال والتفاعل الكلي لهذه الخلية على النحو التالي:
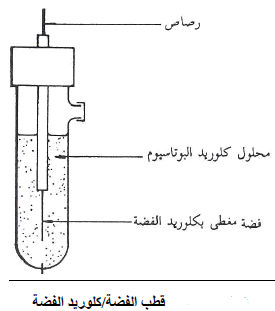
ثانيًا: قطب الفضة / كلوريد الفضة Silver/Silver Chloride Electrode
– يتكون من قضيب فضة محاط بكلوريد فضة صلب مغموراً في محلول يحتوي على أيونات الكلوريد.
– يمكن استخدام قطب الفضة/كلوريد الفضة كقطب قياسي مثل الكالوميل لتعيين قيمة الجهد لأى قطب بتكوين خلية منه ومن القطب المراد حساب قيمة جهده ومن ثم تعيين قيمة (e.m.f) للخلية. وحيث أن قيمة جهد قطب الفضة معلومة فأنه يمكن تعيين قيمة جهد القطب الآخر.
– يعتمد جهد قطب الفضة/كلوريد الفضة على تركيز أيون الكلوريد كما هو الحال في قطب الكالوميل كما هو مبين بالجدول التالي:
– تكون تفاعلات الأكسدة (كمصعد) والإختزال (كمهبط) لهذا القطب على النحو التالي:
– يوضح الشكل التالي قطب الفضة/كلوريد الفضة.
– يعين جهد هذا القطب بتوصيله بقطب الهيدروجين وعمل خلية من هذين القطبين:
وتفاعلات الأكسدة والاختزال والتفاعل الكلي لهذه الخلية على النحو التالي:
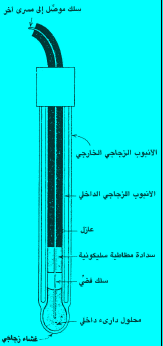
ثالثًا: القطب الزجاجي Glass Electrode
يعتبر جهاز قياس الحموضة (pH meter) من أنسب الطرق لقياس تركيز أيون الهيدروجين في المحلول ويعتمد على قياس ايونات الهيدروجين [H+] في محلول مجهول ولك بقياس فرق الجهد بين نقطتين أحدهما قياسي (قطب الكالوميل) والآخر القطب الزجاجي.
تركيب القطب الزجاجي
– يتكون القطب الزجاجي من غشاء زجاجي وقيق ذو حساسية لأيون الهيدروجين (أنظر الأشكال التالية) ولا يسمح الغشاء الزجاجي بنفاذ ايونات الهيدروجين من المحلول.
– لكل فرق تركيزي أيونات الهيدروجين بين المحلول الخارجي والمحلول داخل القطب يحدث فرقاً في جهد القطب عبر الغشاء الزجاجي. ويحدث فرق الجهد في منطقة من الغشاء الزجاجي التى تتكون من خمسة إجزاء:
محلول خارجي | طبقة جيلاتين مائي | طبقة زجاجية جافة | طبقة جيلاتين مائي | محلول داخلي
– يتكون جيلاتين الزجاج المائي من حمض السيليكا H2SiO4 الذي يحدث به الاتزان التالي أثناء مرور التيار:
قد يحدث تبادل لأيون العنصر القلوي في الزجاج بأيون الهيدروجين. ويمر تيار الكهرباء أثناء تحرك ايونات العنصر القلوي من اختلاف تراكيز أيونات الهيدروجين.
– يمر عبر القطب الزجاجي تياراً صغيراً ينشأ من فرق الجهد الناتج على جانبي الغشاء.
– يتحمل قطب الزجاج الاستخدام لفترة طويلة قد تمتد لعدة سنوات.
– بمعايرة جهاز قياس الحموضة pH باستخدام محلول منظم له حموضة محددة يمكن بعدها قياس pH من قراءة مباشرة على الجهاز وبانحراف صغير لا يتعدى الخطا فيه ± 0.01)) من وحدات pH.