خلية دانيال الجلفانية Daniel cell
– في هذا الموضوع سيتم مناقشة تركيب خلية دانيال الجلفانية Daniel cell ومكوناتها وكذلك التفاعلات الحادثة بداخلها.

محتويات الموضوع
تعريف الخلايا الجلفانية
– الخلية الجلفانية عبارة عن الوسيلة التى يتم بها تحويل الطاقة الكيميائية إلى طاقة كهربية نتيجة لحدوث تفاعلات كيميائية
– أو هي النظام الذي يمكن من خلاله الحصول على تيار كهربائي كنتيجة لبعض التغيرات أو التفاعلات الكيميائية.
– الخلية الجلفانية تتكون من قطبين معدنيين مختلفين (أحدهما سالب والآخر موجب) مغمور كل منهما فى محلول أملاحه (محلول يحتوي على أيونات هذا القطب)
– ويمكن تعريف القطبين كما يلي:
(1) المصعد (الآنود anode)
– وهو قطب الخلية الجلفانية الذي تحدث عنده عملية انطلاق الأيونات الموجبة من القطب إلى المحلول.
– وبذلك يكون القطب سالب التكهرب لاكتساب إلكترونات سالبة.
– بينما يكون المحلول موجب التكهرب لاكتساب أيونات موجبة.
(2) المهبط (الكاثود cathode)
– وهو القطب الذي يتم عنده عملية اختزال الأيونات الموجبة بإلكترونات هذا القطب ليصبح القطب موجب التكهرب. بينما يكون المحلول سالب التكهرب لفقد أيونات موجبة.
– بالإضافة إلى ذلك فأن القوة الدافعة الكهربية (electromotive force) (e.m.f) لهذه الخلية تتناسب طردياً مع شدة التفاعل الكيميائي الذي يتم بها.
التفاعلات الحادثة فى الخلية الجلفانية (خلية دانيال)
– يحتوي القطب السالب (المصعد anode) فى الخلية الجلفانية على عدد كبير من الإلكترونات أكثر من التي يحتويها القطب الموجب (الكاثود cathode). وبناءاً على ذلك فأن التيار الكهربائي يسري فى الدائرة الخارجية من القطب السالب إلى القطب الموجب.
– وبمعلومية اتجاه التيار فإنه يمكن بسهولة معرفة التفاعلات الكيميائية المسئولة عن انطلاق الإلكترونات عند القطب السالب باكتساب إلكترونات من القطب الموجب وذلك من الطبيعة الكيميائية لمواد الأقطاب المستخدمة على أساس نظرية الأكسدة والاختزال.
– العملية الكيميائية التى تتم عند القطب الموجب هي عملية اختزال (اكتساب إلكترونات).
– بينما التي تتم عند القطب السالب هي عملية أكسدة (فقد إلكترونات).
– والمجموع الجبري لكلا التفاعلين الحادثين عند القطب السالب والموجب سوف يعطي التفاعل الكلي.
– والمجموع الجبري لجهد القطبين سوف يعطي القوة الدافعة الكهربية للخلية.
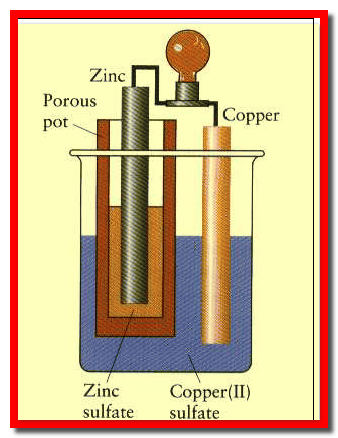
تركيب خلية دانيال الجلفانية Daniel cell
– تتألف خلية دانيال الجلفانية من قطبين كما يلي:
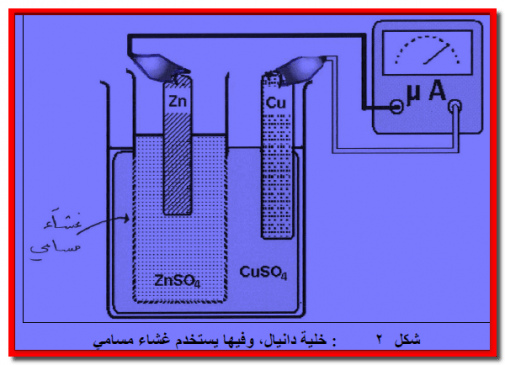
(أ)- قطب خارصين (زنك) Zn مغمور فى محلول أيوناته (مثاله قطب خارصين مغمور فى محلول كبريتات خارصين ZnSO4).
(ب) قطب نحاس Cu يغمر في محلول أيوناته ( مثاله قطب نحاس مغمور فى محلول كبريتات نحاس CuSO4).
– يفصل بين المحلولين ZnSO4 (aq) , CuSO4 (aq) فاصل (حاجز، غشاء) مسامي شكل رقم (1) ، (2) يسمح فقط بتبادل الأيونات بين المحلولين (عند مرور التيار الكهربائي) ولكنه يمنع الامتزاج الميكانيكي بينهما.
– ويمكن أن يوضح المحلولان فى وعائين (إنائين) منفصلين (two beakers). ويسمى كل إناء بنصف خلية (half cell). وأحياناً يسمي بقطب الخلية (cell electrode)
– كما يسمى التفاعل الحاصل فى نصف الخلية بتفاعل نصف الخلية (half cell reaction).
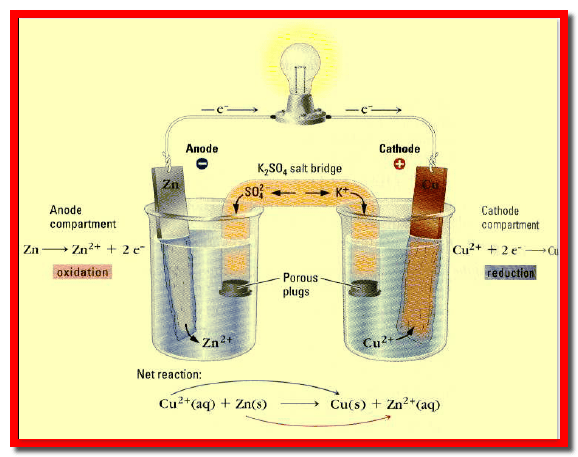
– ويوصلان بأنبوبة (قنطرة ملحية salt bridge ) على شكل حرف (U) ( الشكل رقم 3).
– علاوة على ذلك تملأ القنطرة الملحية بمحلول مشبع من محلول إليكروليتى لمادة أيونية مثل نترات البوتاسيوم أو كلوريد البوتاسيوم واللذان لا يحدث لهما أي تغير (تفاعلات) عند توصيل الخلية.
وظيفة القنطرة الملحية salt bridge
(1) توصيل الدائرة الكهربائية للسماح بانتقال الإلكترونات.
(2) تعويض نقص الأيونات فى المحاليل وذلك بأن يسمح المحلول فيها بانتقال الأيونات بين الأيونات بين الإناءين من أجل المحافظة على تعادل المحاليل كهربائياً.
(أي يتساوى فى المحلول عدد الشحنات الموجبة وعدد الشحنات السالبة وتكون المحصلة صفراً – أي متعادلة كهربائياً).
(3) منع التماس (الإيصال) المباشر بين المواد المتفاعلة والمواد الناتجة.
– يوصل القطبان خارجياً عن طريق دائرة خارجية تتألف من موصل معدني (سلك كهربائي) متصل بجلفانومتر (فولتاميتر V) (أو أي جهاز لقياس شدة التيار) وتسري الإلكترونات عبر هذا الموصل.

التفاعلات الحادثة فى خلية دانيال
– عند توصيل قطبي الخلية عن طريق دائرة خارجية (سلك + جلفانومتر) نلاحظ مرور تيار كهربائي مع حدوث التغيرات الآتية كما يلي:
(1) نقص وزن قطب الخارصين
– عند قطب الخارصين تنتج الإلكترونات بسبب أكسدة (ذوبان) معدن الخارصين إلى أيونات خارصين (تفقد ذرات الخارصين إلكتروناتها متحولة إلى أيونات) حسب التفاعل التالي:
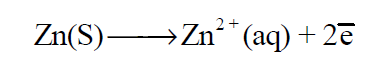
وبالتالي يزداد تركيز أيونات الخارصين فى المحلول.
– هذا القطب هو الذي يدفع الإلكترونات فى الدائرة الخارجية ولذلك يسمى مصعداً (آنود anode) ويوصف بأنه سالب لتولد الإلكترونات عنده.
– كما أن قيمة جهد هذا القطب فى السلسلة الكهروكيميائية أكثر سالبية من جهد قطب النحاس. وينشأ نتيجة لذلك فرق جهد يسمى جهد الخارصين.
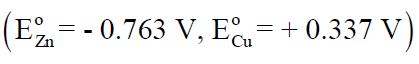
– كما تنتقل الإلكترونات المتولدة عند قطب المصعد Zn عبر الموصل الخارجي (السلك المعدني) وبالتالي تصل إلى القطب الآخر في الخلية (قطب النحاس)، ويسمى هذا القطب مهبطاً (كاثوداً cathode) ، ويوصف بأنه قطب موجب .
(2) زيادة وزن قطب النحاس
– عند وصول الإلكترونات إلى هذا القطب فإنها ستقوم باختزال أيونات النحاس المتصلة بالقطب (الموجودة فى محلول كبريتات النحاس) طبقاً للتفاعل التالي:
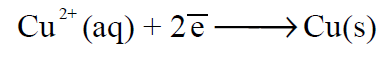
– فتتحول إلي ذرات نحاس تترسب على قطب النحاس، مما ينتج عنه نقص فى تركيز أيونات النحاس فى منطقة المهبط وزيادة فى وزن قطب النحاس. ويسمى هذا التفاعل بتفاعل قطب النحاس وينشأ فرق جهد يسمى جهد قطب النحاس. وعلى هذا الأساس يعتبر النحاس في هذه الخلية هو المهبط (Cathode).
(3) باستمرار التفاعلين
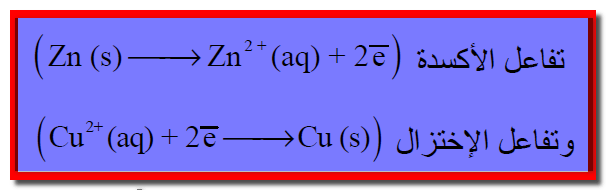
– تتولد كمية وافرة من أيونات الخارصين عند المصعد (مما يزيد من إيجابية المحلول). بينما تستهلك كمية مكافئة من أيونات النحاس عند المهبط (مما يزيد من سالبية المحلول).
– ما يحدث من زيادة إيجابية وسالبيه المحلول يخالف مبدأ المحاليل دائماً متعادلة كهربائياً أي أن عدد أيوناتها الموجبة = عدد أيوناتها السالبة.
– وهذا المبدأ لكي يتحقق فى محاليل خلية دانيال فإنه:
أولاً/ فى حالة الخلية المصممة بغشاء مسامي
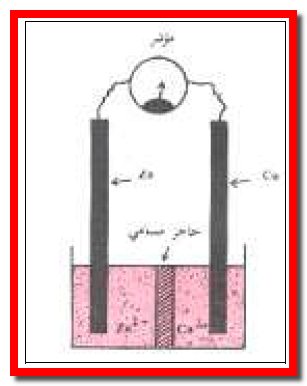
– تنتقل الكاتيونات ( الأيونات الفائضة من أيونات الخارصين) من منطقة المصعد إلى منطقة المهبط. وبالتالي تعوض النقص في أيونات النحاس فى تلك المنطقة.
– أو بدلاً من ذلك تنتقل الأنيونات (الكبريتات ) من منطقة المهبط إلى منطقة المصعد لتعادل الشحنات الفائضة ( أيونات الخارصين) في تلك المنطقة.
– وعملياً فإن الأيونات ( الكاتيونات والأنيونات) تنتقل فى الاتجاهين.
ثانيًا/ في حالة الخلية المصممة بقنطرة ملحية
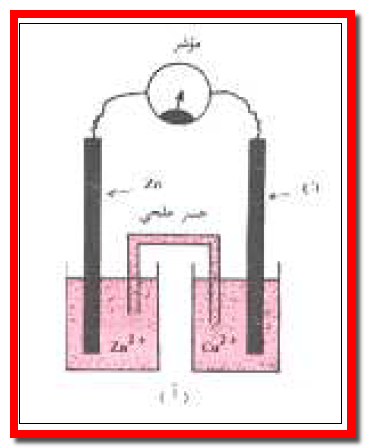
– فإن الايونات في هذه القنطرة تهاجر إلى نصفي الوعاءين لتحافظ على التعادل الكهربائي.
– فإذا كان الملح الموجود بالقنطرة هو (KCl) فإن أيونات (–Cl) تغادر إلى منطقة المصعد (الأكثر إيجابية) لتعادل المحلول وأيونات (+K) تغادر إلي منطقة المهبط (الأكثر سالبية) لتعادل المحلول.
– ويكون التفاعل في الخلية السابقة هو بجمع معادلتي تفاعل الأكسدة والاختزال جمعاً جبرياً كما يلي:
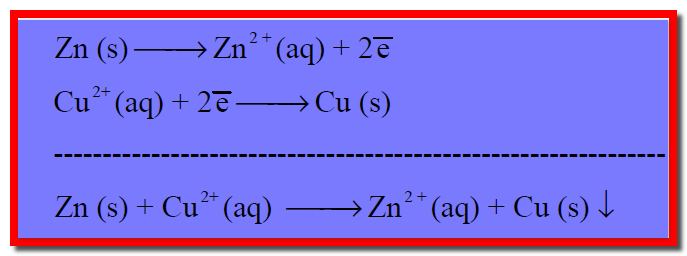
– ويستمر مرور التيار الكهربائي بين قطب الخارصين وقطب النحاس حتى يتم ذوبان كل قطب الخارصين في محلول كبريتات الخارصين أو ترسيب كل أيونات النحاس من محلول كبريتات النحاس فيتوقف مرور التيار الكهربائي فى الدائرة الخارجية.
المراجع : تركيب خلية دانيال الجلفانية Daniel cell – الفصل الثاني “الخلايا الجلفانية” من كتاب الكيمياء الكهربية – الجزء الأول للمؤلف/ عمر بن عبدالله الهزازي أستاذ قسم الكيمياء – كلية العلوم التطبيقية – جامعة أم القرى.