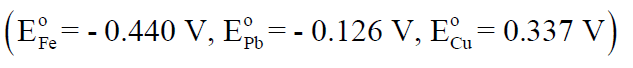التنبؤ بحدوث تفاعل كيميائي عن طريق قياسات القوة الدافعة الكهربية
– في هذا الموضوع سيتم مناقشة كيفية التنبؤ بحدوث تفاعل كيميائي عن طريق قياسات القوة الدافعة الكهربية.
محتويات الموضوع
أدلة حدوث تفاعل كيميائي
– رغم أن بعض التفاعلات الكيميائية يصعب اكتشافها إلا أن الكثير منها يظهر مؤشرات فيزيائية (محسوسة) على حدوثها.
– وهذه بعض المؤشرات التى تدل على حدوث التفاعل الكيميائي كما يلي:
- تغير درجة الحرارة
- تغير اللون
- ظهور رائحة.
- تصاعد غاز
- تكون راسب أو مادة صلبة.
- ظهور ضوء أو شرارة
- سريان التيار الكهربي
- تغير لون كاشف كيميائي
التنبؤ بحدوث تفاعل كيميائي عن طريق قياسات القوة الدافعة الكهربية
– حينما يكون لدينا تفاعل كيميائي معين فإنه يمكن التأكد من إمكانية حدوثه من عدمھا من خلال تجزئة التفاعل إلى نصفي تفاعل أكسدة واختزال.
– ومن ثم حساب جھد الخلية الكھروكيميائية التي تؤدي إلى حدوث ذلك.
– ومنه تتحدد إمكانية حدوث تفاعل كيميائي إن كان الجھد موجباً وعدم إمكانية حدوثه إن كان الجھد سالباً.
- الجهد موجب ← يحدث تفاعل كيميائي
- الجهد سالب ← لا يحدث تفاعل كيميائي
مسائل محلولة للتنبؤ بحدوث تفاعـل كيميائي
مثال (1)
بين ھل يمكن حدوث كل من التفاعلين الآتيين:
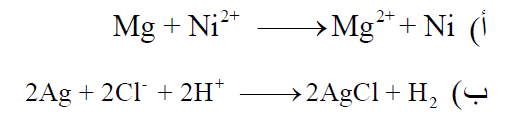
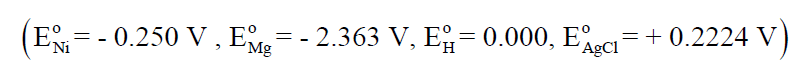
(أ) يمكن فصل التفاعل الأول كما يلي:

(ب) يمكن فصل التفاعل الثاني كما يلي:

– وبالنسبة لحدوث التفاعلات الكيميائية فإنه يعبر عنها بطرق مختلفة، فمثلاً يتم في المحاليل أحياناً أن تحل أيونات ما محل أيونات أخري في المحلول من خلال اختزال الأولى وأكسدة الثانية ، ومثل هذه العملية تسمى إحلال.
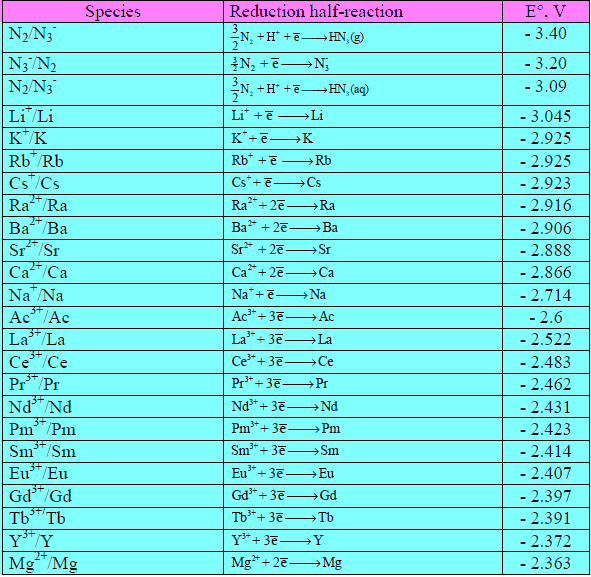
– كما يمكن معرفة إمكانية حدوثها بالاستفادة من السلسلة الكهروكيميائية.
مثال (2)
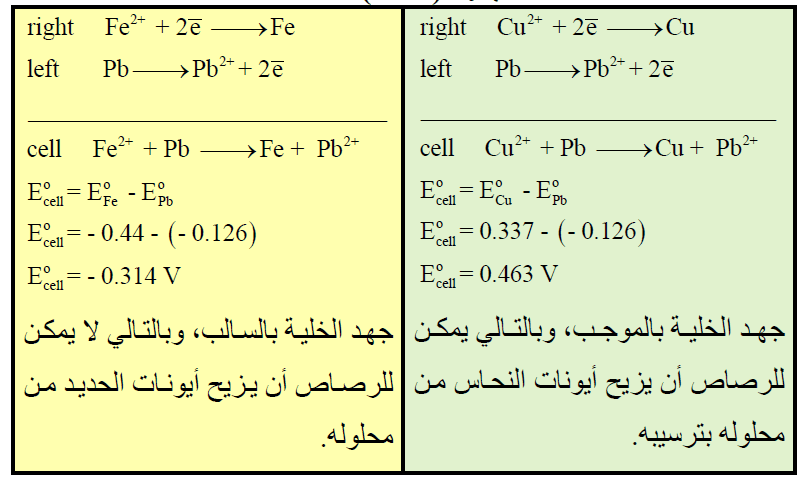
ھل يستطيع الرصاص إحلال ( أن يحل محل ) كل من الحديد(II) والنحاس(II) في المحاليل عند (25 ºC) علماً بأن جھود الإختزال القياسية:
الحل:
– نكون خلية من الرصاص في محلول الحديد(II) ، وخلية ثانية من الرصاص فى محلول النحاس (II) ثم نحسب الجهد لكل خلية كما في الجدول التالي:
– ومن ناحية أخري فأن أكسدة المعادن تعرف بالتآكل أيضاً.
– ومن الممكن حماية المعادن من التآكل بمنع حدوث الأكسدة ويتم ذلك بواسطة مواد أخري تختزل المادة التي يراد حمايتها.
– كما يمكن معرفة المواد المناسبة لحماية مواد أخري من التآكل أيضاً بالاستفادة من السلسلة الكهروكيميائية.
المراجع : الفصل الرابع عشر ” التطبيقات العملية بإستخدم قياسات القوة الدافعة الكهربية ” من كتاب أسس ومبادئ الكيمياء الكهربية الجزء الثاني للمؤلف / عمر بن عبدالله الهزازي أستاذ قسم الكيمياء – كلية العلوم التطبيقية – جامعة أم القرى