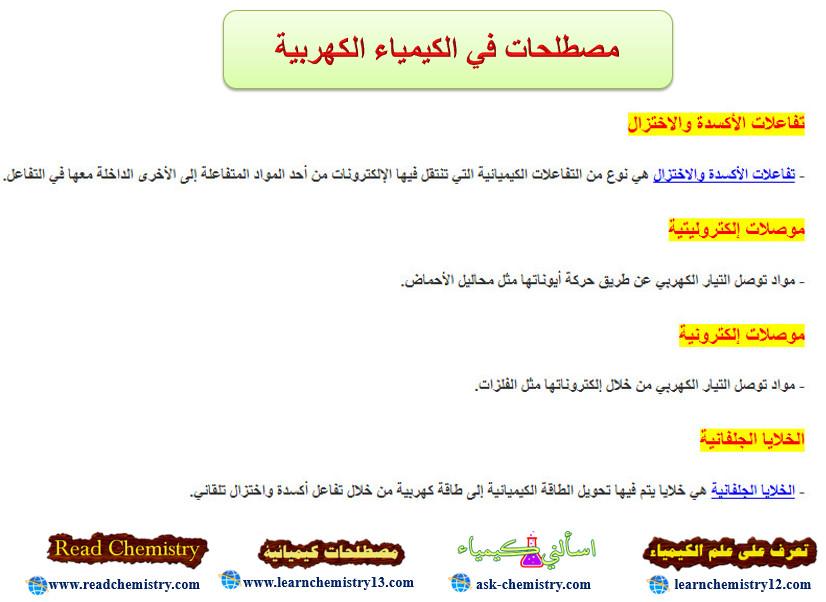
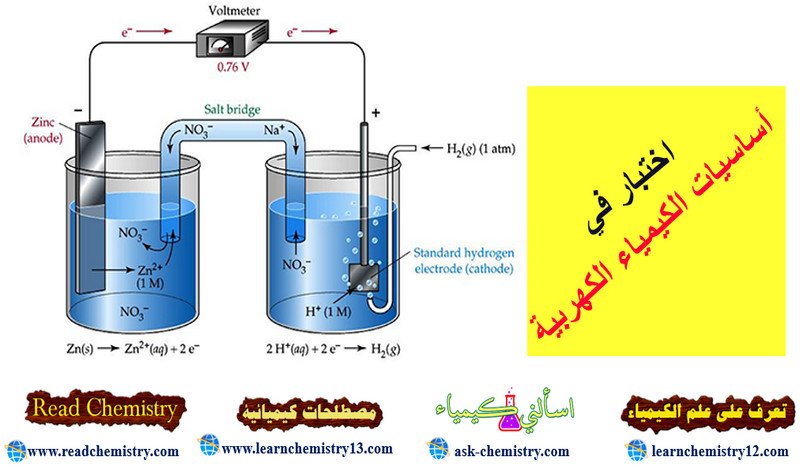
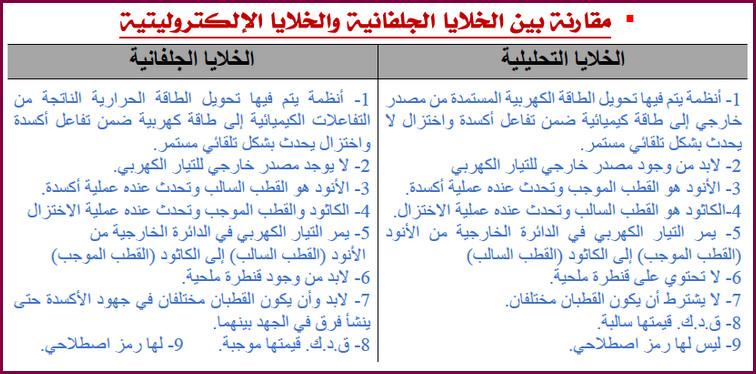
الكيمياء الكهربية
حساب جهد الخلية (القوة الدافعة الكهربائية) Calculation of EMF

حساب جهد الخلية (القوة الدافعة الكهربائية (EMF
– يعرف الجهد الكهربائي بأنه القدرة على اكتساب شحنة موجبة ووحدته قياسه هى الفولت.
– لحساب جھد الخلیة، القوة الدافعة للإلكترونات، فإنه یستخدم قیم جھود الإختزال للعناصر والمرتبة في جداول السلسلة الكھروكیمیائیة، وھي بوحدة الفولت، ویطبق علیھا العلاقة التالیة:

حيث:
Eocell = جهد الخلية القياسي
ويكون Eocathode = جهد الأختزال القياسي لقطب المهبط
Eoanode = جھد الإختزال القیاسي لقطب المصعد
– حیث أن قیمة جھد الاختزال لقطب ما ھي نفس قیمة جھد الأكسدة لذلك القطب ولكن بعكس الإشارة. وھذا ھو السبب في وضع إشارة سالب قبل جھد الإختزال لقطب المصعد Eocathode في المعادلة السابقة، وذلك لأن القیمة المأخوذة له ھي جھد اختزال والإشارة السالبة تعطي قیمة جھد الأكسدة، بمعنى آخر أن جھد الخلیة یمكن أن یحسب بإحدى طریقتین:


وسنتبع الطریقة الثانیة في جمیع حساباتنا خشیة اللبس أي العلاقة:
فستعطى جمیع جھود الأقطاب على ھیئة جھود اختزال.
– في حالة الترميز فإن:
(1) قطب المهبط (الكاثود cathode) یكون جھة الیمین لذلك یمكن أن یستبدل الرمز Ecathode بالرمز EoR حيث (R) تعني يمين (Right).
(2) قطب المصعد (الأنود anode) یكون جھة اليسار لذلك یمكن أن یستبدل الرمز Eanode بالرمز EoL حيث (L) تعني يسار (Left).
وبالتالي فإن جھد الخلیة یحسب بأحد الصیغتین:
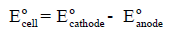
أو
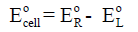
– ورتبت العناصر في جدول السلسلة الكھروكیمیائیة على أساس تفاعلات الاختزال، وبالتالي القیم تؤخذ مباشرة من الجدول بدون تغییر إشارة الجھد (عندما یكون التفاعل تفاعل أكسدة) بسبب ما ذكر أعلاه ( الجداول في أسفل الموضوع). ویكون القطب الذي له جھد اختزال أكبر ھو المھبط والقطب الذي له جھد اختزال أصغر ھو المصعد.
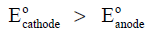
ملاحظات هامة عند حساب جهد الخلية
(1) قيمة القوة الدافعة الكهربائية (جهد الخلية الجلفانية) دائماً موجبة (Eo = +) في حالة التفاعلات التلقائية (القابلة للحدوث في ظروف التجربة).
(2) قيمة القوة الدافعة الكهربائية (جهد الخلية الجلفانية) دائماً سالبة (Eo = – ) في حالة التفاعلات الغير التلقائية (الغير القابلة للحدوث في ظروف التجربة).
(3) جهد القطب يمكن أن يكون سالباً أو موجباً.
(4) جهد القطب القياسي Eo Standard Potentials هو مقياس لقابلية المصعد للتأكسد أو مادة المهبط للاختزال عند الظروف القياسية.
حساب جهد خلية دانيال Calculation of Daniel Cell potential
– خلية دانيال هي خلية مكونة من قطب النحاس المغمور في أيونات الثنائي وقطب الخارصين المغمور في أيونات الخارصين الثنائي.
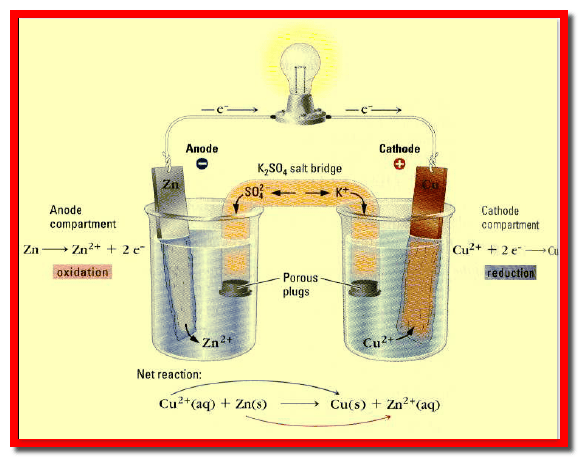
– عند الظروف القياسية يكون جهد الخلية أو قوتها الدافعة الكهربية تساوي (1.0998 V) أي تقريباً (1.1 V).
– ومن المعروف (من جداول السلسلة الكهروكيميائية) أن جهد الاختزال لقطب النحاس القياسي يساوي (+ 0.337 V) مما يعني أن جهد الأكسدة له يساوي (- 0.337) ، حيث أن جهد الاختزال لقطب الخارصين القياسي يساوي (- 0.7628 V) مما يعني أن جهد الأكسدة له يساوي (+ 0.7628 V).
– المعلومات السابقة تعني أن قطب النحاس/ أيونات النحاس الثنائي لأقدر من قطب الخارصين/ أيونات الخارصين الثنائي على أن تحدث عنده عملية الاختزال التالية:
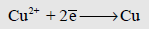
والثاني هو الأقدر على أن تحدث عنده عملية الأكسدة التالية:
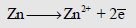
وذلك عند الظروف القياسية.
– يمكن التعبير عن جهود الأقطاب والخلية بأحد الطريقتين التاليين:
الطريقة الأولى:
– أن نأخذ الاختزال للقطب الذي تحدث عنده عملية الاختزال وجهد الأكسدة للقطب الذي تحدث عنده عملية الأكسدة ويكون جهد الخلية هو حاصل جمع الجهدين وليس الفرق بينهما ، ويعبر عن ذلك بالصورة التالية:
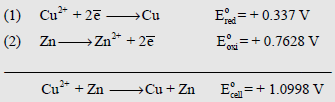
– أي أن جهد الخلية يساوي جهد الاختزال للقطب الذي تحدث عنده عملية الاختزال مضافاً إليه جهد الأكسدة للقطب الذي تحدث عنده عملية الأكسدة أي أن:
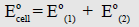
الطريقة الثانية:
– أن نأخذ للقطبين اللذين تحدث عند أحدهما عملية الاختزال وعند الآخر عملية الأكسدة نفس النوع من الجهد أي إما جهد الأكسدة لهما معاً أو جهد الأختزال لهما معاً ويكون عندئذ جهد الخلية هو الفرق بين هذين الجهدين ، ويعبر عن ذلك بالصورة التالية حسب نوع الجهد المأخوذ:
(أ) جهود الأكسدة:
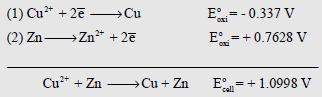
وأي أن جهد الخلية يساوي جهد الأكسدة للقطب الذي تحدث عنده عملية الأكسدة مطروحاً منه جهد الأكسدة للقطب الذي تحصل عنده عملية الاختزال، أي أن:
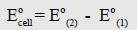
(ب) جهود الاختزال:
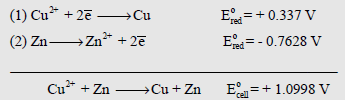
أي أن جهد الخلية يساوي جهد الاختزال للقطب الذي تحدث عنده عملية الاختزال مطروحاً منه جهد الاختزال للقطب الذي تحدث عنده عملية الأكسدة أي أن:
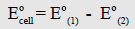
– مما سبق فإن طريقة حساب جهد الخلية تعتمد على نوع الجهد ( اختزال أو أكسدة) المأخوذة لكل قطب. ولكن مهما اختلفت الطريقة فإن جهد الخلية كما هو بديهي سيظل نفسه.
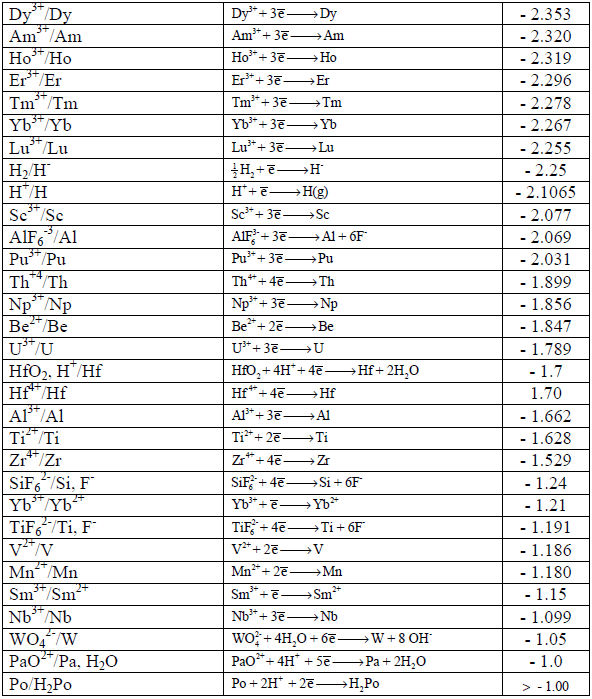
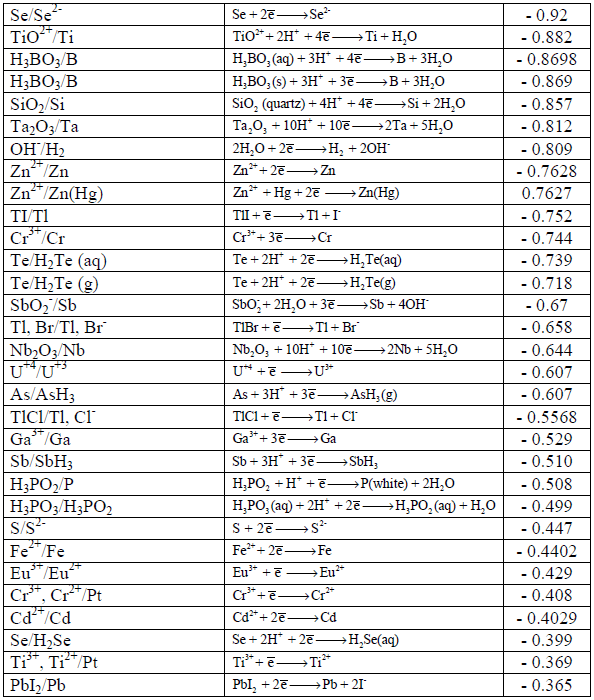
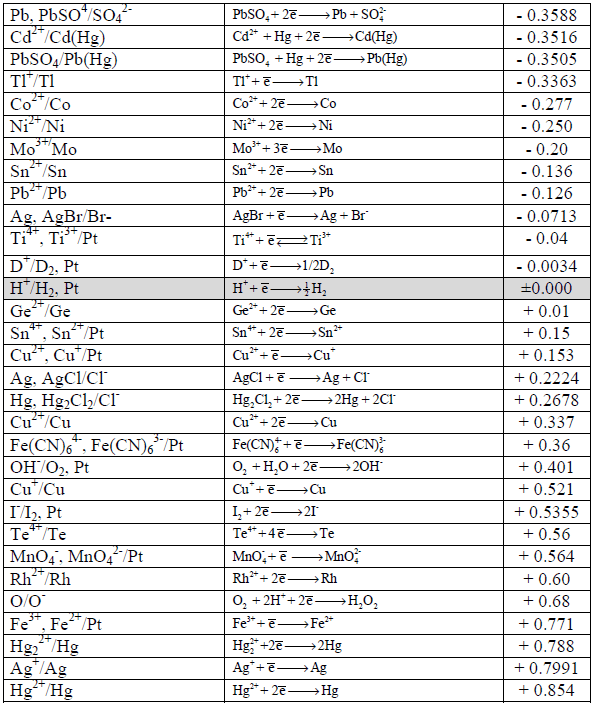
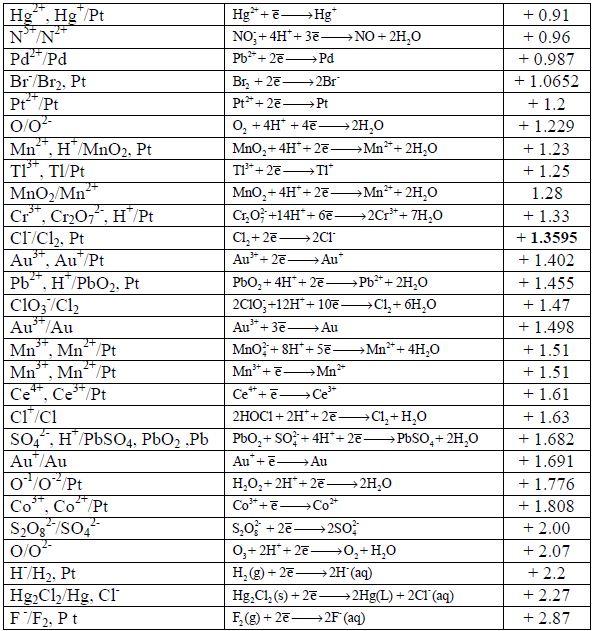
جداول السلسلة الكھروكیمیائیة Electrochemical Series
– رتبت جهود الأقطاب القياسية والتي ترمز لها بالرمز (Eo) في الجداول بناءاً على التناقص في قيم جهود تفاعلات الاختزال أي التزايد في الإيجابية.
– عند كتابة تفاعل أكسدة فإن قيمة الجهد تساوي لما هو مكتوب في جداول الاختزال إلا أنها بعكس الإشارة.
– تسمى الجداول المؤلفة من جهود اختزال أو جهود أكسدة بالسلسلة الكهروكيميائية أو سلسلة الإزاحة أو سلسلة القوة الدافعة الكهربائية.
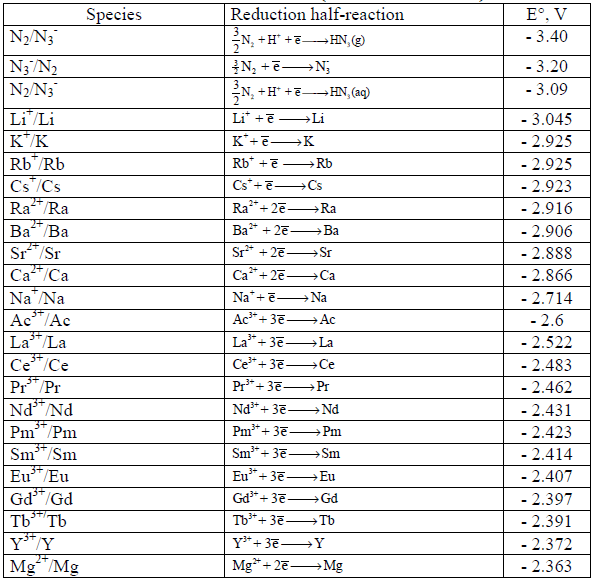
مسألة محلولة
لدیك جھود الاختزال القیاسیة التالیة:
EoZn = – 0.7628 V , EoCd = – 0.4029 V
(أ) أي القطبین ھو المصعد وأیھا المھبط؟
(ب) أكتب تفاعل الأكسدة والإختزال والتفاعل الكلي لخلیة مؤلفة من القطبین أعلاه؟
(جـ) احسب جھد الخلیة القیاسي Eocell
الحل:
بمقارنة قیمة جھد الإختزال للقطبین فإن جھد اختزال الكادمیوم أكبر من جھد اختزال الخارصین:
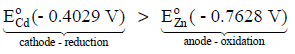
لذلك فالكادمیوم یحدث عند سطحه الإختزال، بینما الخارصین یحدث له أكسدة (تآكل):
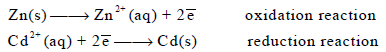
ویكون التفاعل الكلي للخلیة ھو مجموع التفاعلین السابقین:
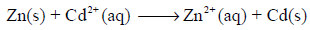
ولحساب جھد الخلیة القیاسي Eocell نتبع العلاقة:
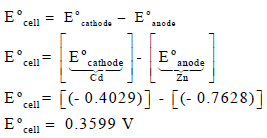
وجهد الخلية = 0.3599 V Eocell يسمى بجهد الخلية القياسي.
وكلمة القياسي تعنى أن:
(1) تركیز المحلولین متساو: [ Zn2+] = [Cd2+] أو تركيز المحلولين يساوي الوحدة (1 M)
(2) درجة الحرارة التي تقاس عندھا التجربة ھي درجة حرارة الغرفة أي (25 Co)
(3) وفي حالة الغازات فإن شروط القیاسیة تعني أیضاً ضغطاً مقداره (1 atm)
وفي حالة مخالفة الشروط السابقة كأن یختلف تركیز المحلولین مثلاً فإننا نطبق علاقة نیرنست التي سنشرحها لاحقاً إن شاء الله، وصیغتھا الریاضیة ھي:
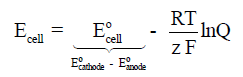
حيث أن:
R = ثابت الغازات ويساوي (8.314 J/mol.K)
T= درجة الحرارة المطلقة بالكلفن (وتساوي الدرجة المئوية + 273)
z = عدد المولات المشاركة في التفاعل الكلي ( أو تفاعل القطب إذا كان المحسوب هو جهد القطب)
F= ثابت فارادي ويساوي (96500 C)
Q= رائز التفاعل وتساوي ثابت الأتزان عند الأتزان
المراجع – كتاب الكيمياء الكهربائية / د.عمر بن عبدالله الهزازي/ قسم الكيمياء-كلية العلوم التطبيقية – جامعة أم القرى/ المملكة العربية السعودية