الكيمياء الكهربية
قياس القوة الدافعة الكهربائية (e.m.f) وطرق تعيين جهد الخلية
أولاً/ قياس القوة الدافعة الكهربية للخلايا الجلفانية
Measurements of Electromotive Force for A Galvanic Cell
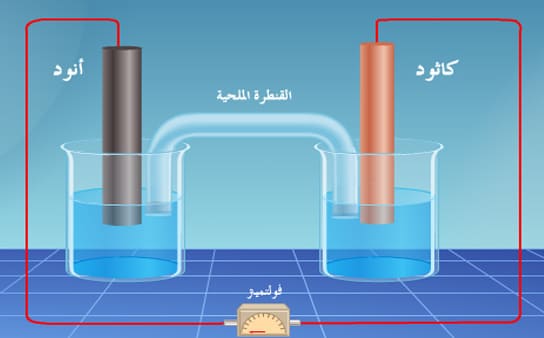
– مرور التيار الكهربي يعنى مرور إلكترونات سالبة التكهرب في الدائرة الخارجية من الآنود إلى الكاثود تتبعه هجرة الأيونات داخل المحلول (الكاتيونات موجبة التكهرب تتجه إلى المهبط والانيونات سالبة التكهرب تتجه إلى المصعد).
– إذا وصل جلفانومتر (مقياس للجهد) بقطبي الخلية الكهربائية من الخارج وقفلت الدائرة بينهما فأننا نلاحظ أن الجلفانومتر سوف تنحرف أبرته (حالياً تستخدم جلفانومترات رقمية) وهذا يدل على مرور تيار كهربي (I) من أحد الأقطاب إلى القطب الآخر.
– مرور هذا التيار الكهربائي في الدائرة يدل على وجود فرق جهد كهربائي بين القطبين وذلك لأنه بدون هذا الجهد لن يمر تيار كهربائي في الدائرة.
– فرق الجهد المسئول عن مرور التيار في الخلية من قطب ذي جهد مرتفع إلى قطب ذي جهد منخفض يسمى بالقوة الدافعة الكهربائية للخلية (electromotive force e.m.f) وتقاس بوحدة الفولت.
– يمكن تطبيق قيمة التيار الكهربائي المار بتطبيق قانون أوم التالي:
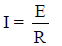
حيث أن:
E: القوة الدافعة الكهربية بالفولت ، R: المقاومة بالأوم
وفي حالة الخلية الجلفانية فإن:
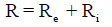
حيث أن:
Re: (Rexternal) مقاومة الدائرة الخارجية (الأسلاك + الجلفانومتر)
Ri: (Rinternal) المقاومة الداخلية للخلية
وبذلك تكون قيمة (I) تساوي:
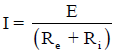
وباستمرار مرور التيار الكهربائي واستمرار تغير المقاومة الداخلية نتيجة لتغيير أوزان الأقطاب وتغير تركيز المحاليل داخل الخلية، فإن القوة الدافعة الكهربائية (e.m.f) تتناقص باستمرار حتى تصل في النهاية إلى الصفر فيقف مرور التيار الكهربائي.
ثانياً/ طرق تعيين جهد الخلية الجلفانية
(1) الطريقة الفولتامترية Voltametric Method
– الطريقة الشائعة لقياس فرق الجهد (طريقة الفولتاميتر) هي إدماج فولتاميتر في الدائرة ثم يقاس الجهد مباشرة.
– طريقة الفولتاميتر عند تطبيقها على الخلايا الكهربائية فأنها تلاقي بعض الصعوبات ومنها:
(أ) سحب جزء من تيار الخلية وهذا يسبب تفاعلات كيميائية عند الأقطاب وبذلك يحدث تغير في تركيز الإلكتروليت عند الأقطاب وعلى ذلك فإن الجهد المقيس يكون أقل من الجهد الحقيقي للخلية.
(ب) نتيجة لمرور تيار في الخلية فإن جزءاً من القوة الدافعة الكهربية سوف يستغل في التغلب على المقاومة الداخلية للخلية وبذلك يكون الجهد المقيس أقل من القوة الدافعة الكهربائية للخلية. ويتضح من تلك المناقشة أن طريقة الفولتاميتر لا تصلح لقياس القوة الدافعة الكهربائية للخلية بدقة.
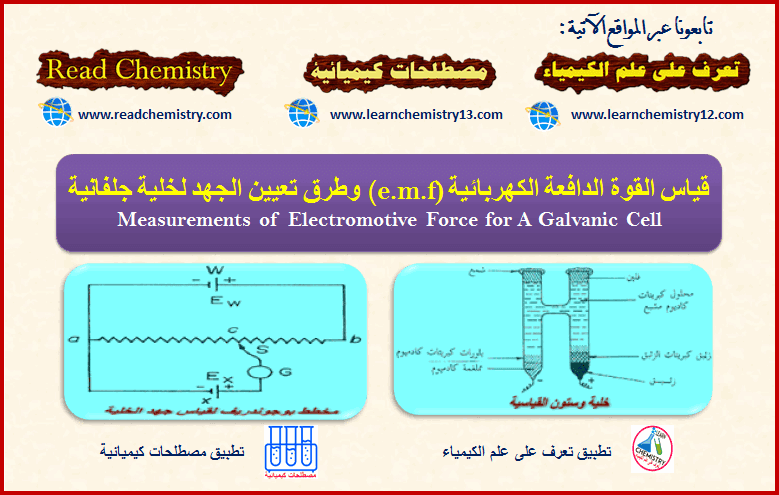
(2) الطريقة الجهدية Potentiometric Method
– تقاس القوة الدافعة الكهربائية عموماً بواسطة الطريقة الجهدية.
– يصمم مقياس الجهد (البوتنشيومتر (potentiometer المستعمل لقياس (ق. د. ك) لخلية جلفانية إعتماداً على تعتمد مبدأ التعويض لبوجوندريف (Poggendorff compensation principle).
– في هذه الطريقة يتم توصيل الخلية قياسية أو مرجعية (مثل خلية وستون القياسية Weston cell التى سنناقشها في موضوع آخر) والخلية المطلوب تعيين (e.m.f) (الخلية المجهولة) لها على التوازي مع الخلية المستخدمة في الدائرة (potentiometer cell)
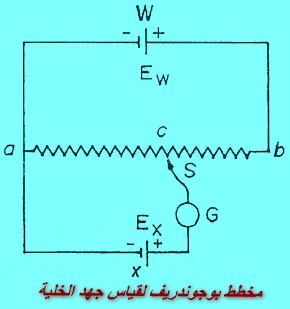
– يتم توصيل الخلية القياسية ( قوتها الدافعة الكهربائية معلومة) أولاً في الدائرة ويتم معادلة قيمتها أولاً على القنطرة المستخدمة وذلك بتحريك سلك الجلفانوميتر (G) على القنطرة بحيث يصبح التيار صفراً.
– لنفرض أن جهد الخلية القياسية (ES) يعادل الطول (AB)
– وباستخدام مفتاح عاكس يتم توصيل الخلية المجهولة بدلاً من الخلية القياسية ويتم معادلة جهدها.
– بنفس الطريقة السابقة ولنفرض أنه يعادل الطول (AB᷆ ) على القنطرة.
– لتعيين قيمة القوة الدافعة الكهربائية للخلية (Eu) يحرك السلك (S) على طول السلك (ab) وذلك حتى لا يمر تيار في الجلفانوميتر.
– عند الاتزان يكون:
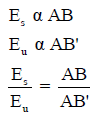
حيث أن:
Es: (Estandard) للخلية القياسية معلوم
Eu: (Eunkown) للخلية المجهولة
ومن العلاقة :
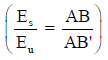
يمكن حساب (Eu) للخلية المطلوب تعيين قيمة القوة الدافعة الكهربائية لها كما يلي:
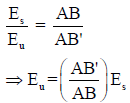
– من هذه الطريقة يتضح أننا تغلبنا على الصعوبات السابقة التي ذكرت في الطريقة الفولتامترية.
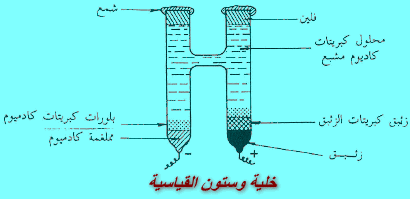
– الشكل التالي توضح خلية وستون التي نستخدمها كخلية قياسية أو مرجعية لقياس القوة الدافعة الكهربية لخلية جلفانية.
المراجع
– كتاب الكيمياء الكهربائية / د.عمر بن عبدالله الهزازي/ قسم الكيمياء-كلية العلوم التطبيقية – جامعة أم القرى/ المملكة العربية السعودية