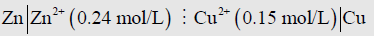الكيمياء الكهربية
علامات ( تعليم أو ترميز) الخلايا الكهروكيميائية Cell Representation

للتبسيط فأننا نلجأ أحياناً إلى طريقة الترميز في تصميم الخلايا الكهروكيميائية بدلاً من التصميم الهندسي الذي يأخذ وقتاً وجهداً. وهناك مجموعة من القواعد التي تتبع من اجل تبسيط هذه الطريقة.
أولا ً/ تمثيل القطب في الخلايا الكهروكيميائية Electrode Representation
– يقصد بتمثيل القطب طريقة كتابته ، أي كيف نعبر عن مكوناته على الورق بشكل مختصر.
– تعتمد طريقة التعبير عن مكونات قطب ما على أساس أن أحد مكونات القطب (ذرات النحاس مثلاً) يكون موجوداً بهيئة مختزلة (reduced form) والآخر (أيونات النحاس الموجبة مثلاً) يكون موجودة بهيئة مؤكسدة (Reduced form) ، والآخر (ايونات النحاس الموجبة مثلاً) يكون موجودة بهيئة مؤكسدة (Oxidized form)
– تكتب الهيئتان (الهيئة المؤكسدة والمختزلة) معاً بجانب بعضهما البعض بحيث تكون الهيئة المختزلة هي التي على اليمين والمؤكسدة هي التي على اليسار.
– يوضع بين الهيئتين خط رأسي يفصل بين القضيب والمحلول الإلكتروليتي المغمور فيه القضيب.
أمثلة على تمثيل القطب في الخلايا الكهروكيميائية
(1) قطب النحاس المكون من قضيب نحاس مغموراً في محلول يحتوي على أيونات النحاس الأحادية يمثل كما يلي:
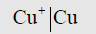
(2) قطب النحاس المكون من قضيب نحاس مغموراً في محلول يحتوي على ايونات النحاس الثنائية يمثل كما يلي:
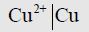
(3) قطب النحاس المكون من قضيب بلاتين مغموراً في محلول يحتوي على ايونات النحاس الأحادية والثنائية يمثل كما يلي:
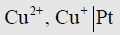
حيث نلاحظ أنه تم الفصل بين الأيونين بفاصلة وليس بخط رأسي لأن كليهما موجوداً بالمحلول.
(4) قد لا يكون القضيب المغمور في المحلول فلزاً صرفاً بل مملغماً أي مخلوطاً مثل قطب الكادميوم المملغم في محلول يحتوي على أيونات الكادميوم ويمكن تمثيله كما يلي:
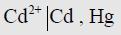
هنا نلاحظ أيضاً أنه فصلت بين الكادميوم والزئبق فاصلة وليس خطاً رأسياً لأنهما يمثلان القضيب.
(5) هناك أقطاب تكون المادة التي تذوب في المحلول من على القطب غازاً والأيونات التي تتجه نحو القطب تتحول إلى غاز وفي مثل هذه الأقطاب فإن القضيب يكون معدناً خاملاً مثل البلاتين ويمرر على سطحه الغاز مثل غاز الهيدروجين ويكون مغموراً في محلول يحتوي على أيونات الهيدروجين، ويكون تمثيله عندئذ كما يلي:
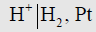
حيث نلاحظ عدم الفصل بين البلاتين وغاز الهيدروجين بخط رأسي بل بفاصلة لأنهما يمثلان القضيب المغمور في المحلول.
– تسمي طريقة كتابة القطب على الورق باسم آخر غير تمثيل القطب وهو مخطط القطب electrode diagram
– تسمي طريقة كتابة القطب على الورق باسم آخر غير تمثيل القطب وهو مخطط القطب electrode diagram
ثانياً/ تمثيل الخلايا الكهروكيميائية Cell Representation
– يقصد بتمثيل الخلية ما يقصد بتمثيل القطب أي كيفية التعبير عن مكونات الخلية على الورق بشكل مختصر.
– يعتمد ذلك على طريقة توصيل قطبي الخلية ويتم ذلك بتمثيل القطبين حسب الطريقة التي ذكرت أعلاه. حيث يكون احدهما إلى اليمين والآخر إلى اليسار
أمثلة
مثال (أ): قطب النحاس/ أيونات النحاس الثنائي الموصول عبر جدار مسامي بقطب الخارصين / ايونات الخارصين الثنائي.
(1) نختار أحد القطبين (وليكن النحاس) ليكون الأيمن وعندئذ سيكتب بالصورة Cu) | (Cu2+ ، أي بحيث تكون الهيئة المختزلة إلى اليمين.
(2) القطب الآخر وهو الخارصين سيكون على اليسار وعندئذ سيكتب بالصورة Zn2+) | (Zn أي بحيث تكون الهيئة المختزلة إلى اليسار.
(3) يوضع بينهما خط رأسي متقطع للدلالة على أن المحلولين متصلان ببعض عبر غشاء مسامي ، وتكون الخلية على النحو التالي:
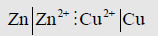
(4) جرت العادة أن يضاف إلى التمثيل ما يدل على التراكيز بالنسبة للمحلولين، فلو كان تركيز المحلول الأيمن (0.15 mol/L) والأيسر (0.24 mol/L) مثلاً، فإن تمثيل الخلية هو:
(5) إذا كان القطبين السابقين موصولان ببعض عبر جسر او قنطرة ملحية فانه يمثل الجسر أو القنطرة الملحية بخطين رأسيين (||) ولذلك فأن تمثيل الخلية سيكون:
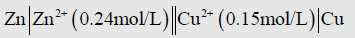
مثال (ب): القطبان مغموران في نفس المحلول مثل الخلية المكونة من قطب الهيدروجين H2 , Pt) | (H+ وقطب الكلور Cl2 , Pt) | (Cl–
(1) نختار أحدهما إلى اليمين والآخر إلى اليسار ونحدد تركيز المحلول وضغطي الغازين ويكون تمثيل الخلية كما يلي:
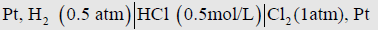
(2) نلاحظ في الوسط وجود محلول واحد هو محلول (HCl)المغمور به قطب الهيدروجين العكسي بالنسبة لأيونات الهيدروجين الموجودة في المحلول. وكذلك قطب الكلور العكسي بالنسبة لأيونات الكلوريد الموجودة في نفس المحلول أيضاً.
** تسمى طريقة كتابة الخلية على الورق باسم آخر غير تمثيل الخلية وهو مخطط الخلية cell diagram
ملخص قواعد تمثيل الخلايا الكهروكيميائية
(1) یوضع خط مائل یفصل بین طورین (|) ، ویدل على اتصالھما كالذي یوجد بین المعدن والمحلولFe2+ , Fe3+) | (Pt أو على السطح بین محلولي سائلین غیر ممتزجین مثل محلول من كبریتات الخارصین ZnSO4 یلامس محلولاً من كبریتات النحاس CuSO4
(2) تستعمل الفاصلة لتدل على وجود أیونات مختلفة أو جزیئات مختلفة موجودة في نفس الطور Fe2+ , Fe3+) | (Pt
(3) یرمز للجسر الملحي أو القنطرة الملحیة (salt bridge) الفاصلة بین نصفي الخلیة (أو أجزائھا) بالرمز (||) ویوضع عادة في ھذه القنطرة الملحیة محلول خامل مثل (KCl).
(4) تستعمل الأقواس لوصف الحالة الفیزیائیة (s, g, L) والتركیز أو الضغط .(aq, 1 M).
(5) المنطقة على یسار القنطرة الملحیة تمثل منطقة المصعد والتي تحدث فیھا عملیة الأكسدة.
(6) المنطقة التي على یمین القنطرة الملحیة تمثل المھبط والتي یحدث عندھا عملیة الإختزال.
وبالتالي فإنه یمكن الترمیز لخلیة دانیال التي سبق تصمیمھا والمؤلفة من قطبي الخارصین والنحاس كما یلي:
أو تكتب بصورة مختصرة:
حيث أن:
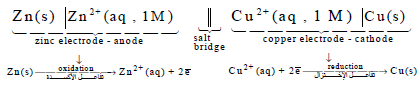
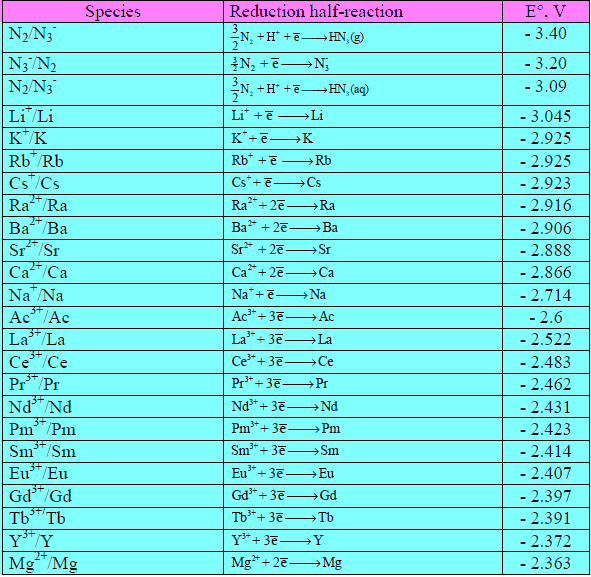
– يلاحظ أن تراكيز المحاليل (ZnSO4 , CuSO4) في الخلية السابقة عبر عنها بتركيز (1 M) وهو ما نسميه الوحدة. وعندما يكون التركيز لمحلولي منطقة المصعد والمهبط متساويين أو يساويان الوحدة فإن جهود الأقطاب يعبر عنها بالجهود القياسية وتؤخذ قيمتها مباشرة من السلسلة الكهروكيميائية.
– السلسلة الكهروكيميائية هي سلسلة رتبت فيها جهود العناصر على أساس تفاعلات الاختزال منسوبة إلى جهد اختزال قطب الهيدروجين الذي افترض اعتباطاً أنه يساوي (EoH= 0) عند جميع درجات الحرارة.
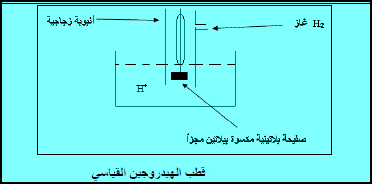
– يتألف قطب الهيدروجين من :
(1) قطب بلاتيني على صلة بأيونات الهيدروجين (من حمض HCl) وتركيزها يساوي الوحدة.
(2) غاز هيدروجين عند ضغط جوي قدره واحد جو (1 atm)
ثالثاً/ أسئلة محلولة على تمثيل الخلايا الكهروكيميائية
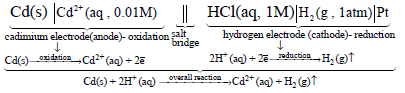
(1) لديك الخلية التالية التي ترميزها كالتالي:
من الترميز أعلاه حدد المصعد والمهبط مع كتابة تفاعلاتهما والتفاعل الكلي للخلية.
الحل:
المصعد هو قطب الكادميوم (Cd) بينما المهبط هو قطب الهيدروجين.
أو بصورة اكثر وضوحاً:
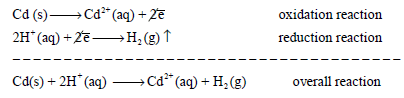
(2) لماذا تكررت العلامة (|) جهة قطب الهيدروجين في الترميز السابق؟
ج: لوجود ثلاث اطوار هي ((HCl (aq)) ، غاز الهيدروجين ((H2(g) ، وقطب البلاتين الصلب ((Pt(s).
(3) ھل یشارك قطب البلاتین في التفاعل؟
ج: لا، لا یشارك قطب البلاتین في التفاعل ، لذلك بعض المراجع تضع علامة “,” بینه وبين الغاز كما يلي: H2(g, atm), Pt
المراجع
– كتاب الكيمياء الكهربائية / د.عمر بن عبدالله الهزازي/ قسم الكيمياء-كلية العلوم التطبيقية – جامعة أم القرى/ المملكة العربية السعودية
– أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية