أسئلة وإجاباتالكيمياء الكهربية
مسائل محلولة على جھد الخلیة الجلفانية – الجزء الأول
في هذا الموضوع سوف نقوم بعرض (10) مسائل وإجاباتها على جهد الخلية الجلفانية
ملاحظات هامة على جهد الخلية قبل البدء في حل المسائل والتمارين
(1) العوامل المؤثرة على قيمة جهد الخلية
(أ) تراكيز الأيونات في نصفي الخلية.
(ب) الضغط الجزئي للغاز المشارك في تفاعلات الخلية.
(جـ) درجة الحرارة.
(2) القانون الهام لحساب جهد الخلية (معادلة نيرنست)
عند الظروف الغير قياسية فأن جهد الخلية يحسب وفقاً لمعادلة نيرنست التالية:
حيث أن:
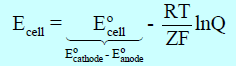
Ecell : جهد الخلية في غير الظروف القياسية.
Eocell: جهد الخلية القياسي.
R : ثابت الغاز العام (R = 8.314 J/mol K)
T: درجة الحرارة المطلقة بالكلفن (K = Co + 273)
Z : عدد الإلكترونات المشاركة في التفاعل (سواء تفاعل أكسدة أو اختزال أو تفاعل كلي بعد توحيد المعاملات في معادلتي الأكسدة والإختزال).
F : ثابت فاراداي (1 F = 96500)
Q : رائز التفاعل وهو عبارة عن النسبة بين حاصل ضرب تراكيز النواتج الأيونية وحاصل ضرب تركيز المتفاعلات الأيونية.
ln : اللوغارتيم الطبيعي ( ويكافئ بقيمة اللوغاريتم العشري ln = 2.303 log10)
(3) دلالة قيمة جهد الخلية
❒ تدل قيمة جهد الخلية على قابلية المواد المتفاعلة لتكوين مواد ناتجة.
❒ إذا كانت قيمة جهد الخلية بالموجب (Ecell = +) فإن التفاعل يكون تلقائياً (spontaneous) أي أن اتجاه الإلكترونات يكون من
اليسار إلى اليمين ، أي يحدث التفاعل كما هو مكتوب في معادلة التفاعل المعطاة
بالمسألة.
اليسار إلى اليمين ، أي يحدث التفاعل كما هو مكتوب في معادلة التفاعل المعطاة
بالمسألة.
❒ إذا كانت قيمة جهد الخلية بالسالب (Ecell = -) فإن التفاعل يكون غير تلقائي (non spontaneous) أي أن اتجاه الإلكترونات يكون من اليمين إلى اليسار ، أي
يحدث التفاعل عكس ما هو مكتوب في معادلة التفاعل المعطاة بالمسألة.
يحدث التفاعل عكس ما هو مكتوب في معادلة التفاعل المعطاة بالمسألة.
❒ مثال توضيحي:
لديك التفاعل التالي:
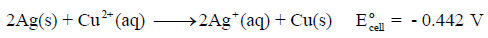
فهذا التفاعل غير تلقائي لأن قيمة جهد الخلية بالسالب ، وبالتالي فإن التفاعل التلقائي
هو عكسه أي:
هو عكسه أي:
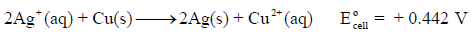
ونلاحظ أنه عند عكس التفاعل فإن قيمة جهد التفاعل تعكس.
مثال (1)
لديك الخلية التالية:
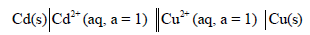
عند درجة حرارة 298 K ، فإذا علمت أن جهود الاختزال القياسية هي:
EoCd = – 0.4029 V , EoCu = + 0.337 V
أكتب تفاعل الخلية واحسب جهدها.
الحل:
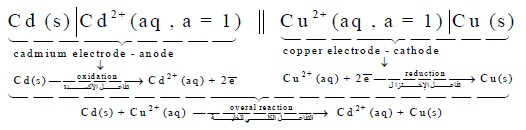
ولحساب جهد الخلية نتبع العلاقة التالية:
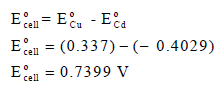
مثال (2)
لدیك الجھود الاختزالية القیاسیة التالیة:
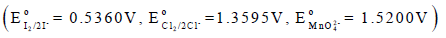
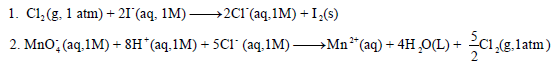
(أ) أكتب تفاعلات الأكسدة والاختزال من معادلة التفاعل الكلي للتفاعلین ( ٢ ،١)
(ب) احسب جھد الخلیة القیاسي.
الحل:
بالنسبة للمعادلة (1):
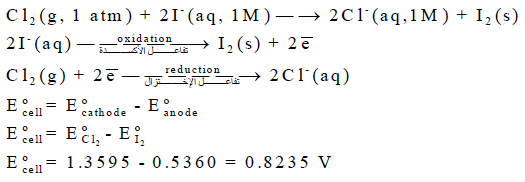
أما المعادلة (2):
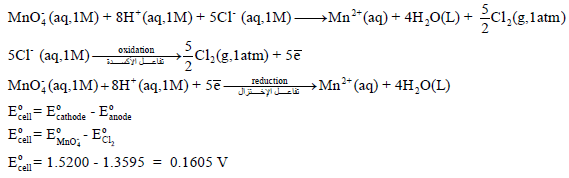
ملحوظة هامة:
عندما یكون لدینا معادلة فإننا نحدد قطب المصعد أو المھبط بناءً على المعادلة ولیس على قیم جھود الاختزال المعطاة. وقد توافق المعادلة نفس دلالات قیم جھود الاختزال القیاسیة وقد تخالفھا. وعند موافقتھا لھا فإن جھد الخلیة تكون قیمته بالموجب ویوصف التفاعل بأنه تلقائي الحدوث. أما عندما یكون جھد الخلیة بالسالب فیوصف التفاعل المعطى بأنه غیر تلقائي.
مثال (3)
أرسم الخلیة الكھروكیمیائیة التي یحدث فیھا التفاعل التالي:
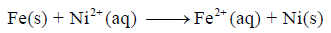
ثم بين :
(أ) المصعد والمھبط واتجاه حركة الإلكترونات على الرسم.
(ب) التفاعلات الحادثة على كل قطب.
(جـ) الجھد القیاسي للخلیة علماً بأن جھد الاختزال القیاسي:
EoFe = – 0.44 V , EoNi = – 0.250 V
(د) ھل التفاعل تلقائي أم لا؟ ولماذا؟
الحل:
(أ)
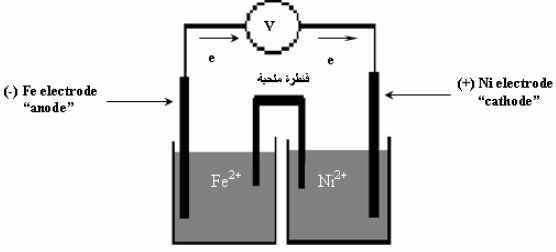
(ب) التفاعلات الحادثة على كل قطب:

(جـ) حساب الجھد القیاسي للخلیة:
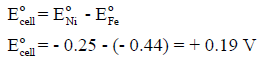
(د) تفاعل الخلية تلقائي ، لأن جهد الخلية بالموجب (+ 0.19 V)
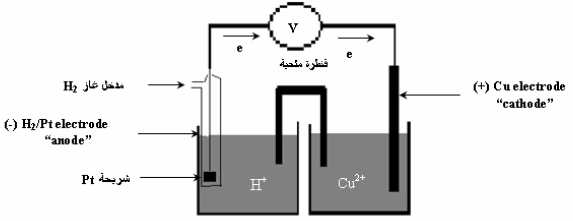
مثال (4)
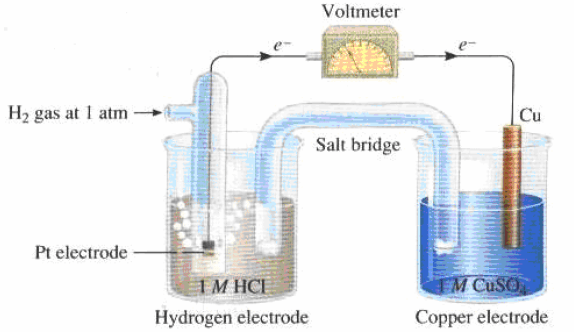
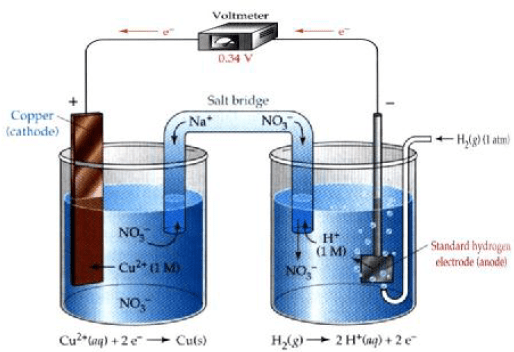
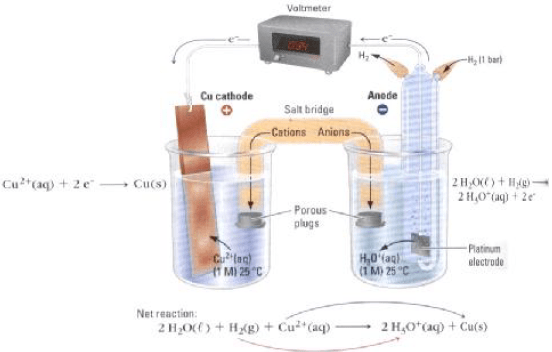
أرسم نموذجاً لخلیة كھروكیمیائیة (جلفانیة) مكونة من قطب النحاس (II) ، ومن غاز الھیدروجین في محلول حمض الكبریت، فإذا كان جھد الاختزال القیاسي للنحاس هو (EoCu = + 0.34 V) . فاكتب التفاعلات الحادثة عند كل قطب في الظروف القیاسیة. واحسب الجهد القياسي للخلية.
الحل:
الأشكال التالية تمثل تصمیماً لخلیة كھروكیمیائیة مؤلفة من قطبیي الھیدروجین والنحاس:
التفاعلات الحادثة عند الأقطاب:

مثال (5)
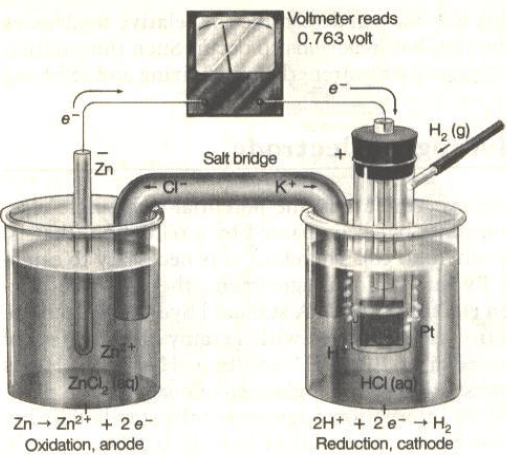
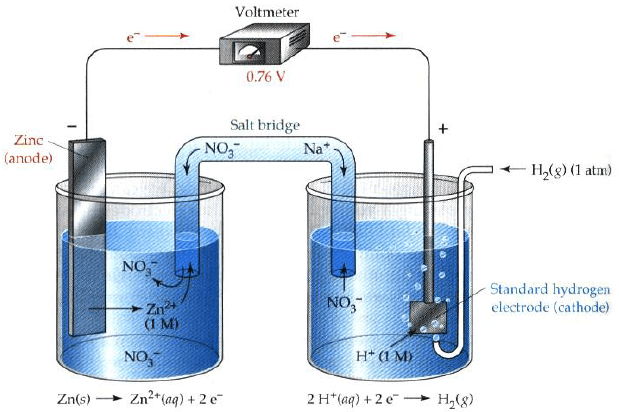
أرسم نموذجاً لخلیة كھروكیمیائیة (جلفانیة) مكونة من قطب الخارصين (II) ، ومن غاز الھیدروجین في محلول حمض الكبریت، فإذا كان جھد الاختزال القیاسي للخارصين هو (EoZn = – 0.7642 V). فاكتب التفاعلات الحادثة عند كل قطب في الظروف القیاسیة. وأحسب الجهد القياسي للخلية.
الحل:
الأشكال التالية تمثل تصمیماً لخلیة كھروكیمیائیة مؤلفة من قطبیي الھیدروجین والخارصين:
مثال (6)
لدیك خلیة مؤلفة من قطبي الفضة Agوالنحاس Cu والتي لها جهود اختزال قياسية:
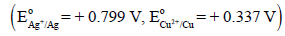
مثل الخلیة بطریقة الترمیز والتصمیم مبیناً تفاعلات الأكسدة والإختزال والتفاعل الكلي للخلیة.
الحل : یمكن تمثیل الخلیة بالترمیز التالي:
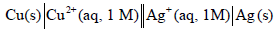
والتفاعل الكلي لھا:
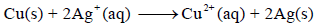
ويمكن تصميم الخلية كالتالي:
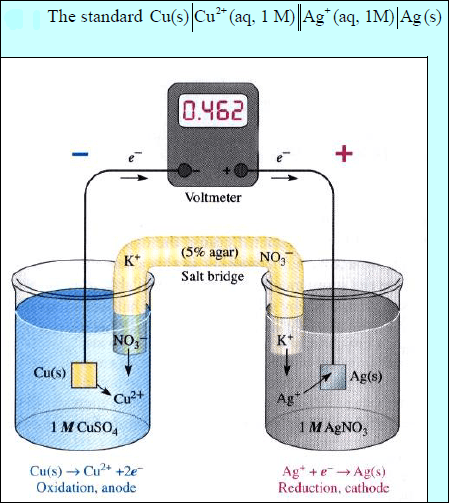
مثال (7)
(أ) أكتب التفاعل الكیمیائي لتفاعل الخلیة الناتج من أنصاف التفاعلات التالیة:
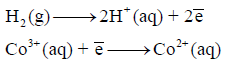
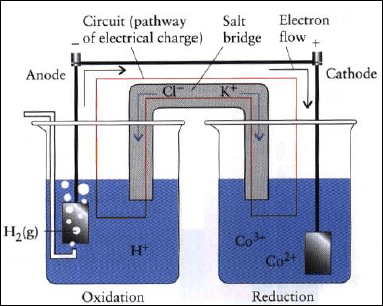
(ب) بافتراض استخدام البلاتین ، أكتب ترمیز الخلیة (cell diagram)وارسم صورة تخطيطية (schematic picture) للخلية ومحتوياتها ، وعلم (label) المصعد والمهبط وحدد اتجاه تدفق الإلكترون (direction of electron flow) .
الحل:
(أ) التفاعل الكلي للخلیة:
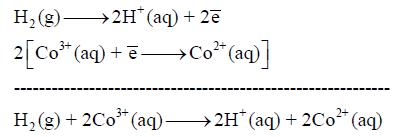
(ب) ترمیز الخلیة:
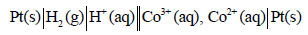
والتصمیم الھندسي للخلیة كما في الشكل التالي:
مثال (8)
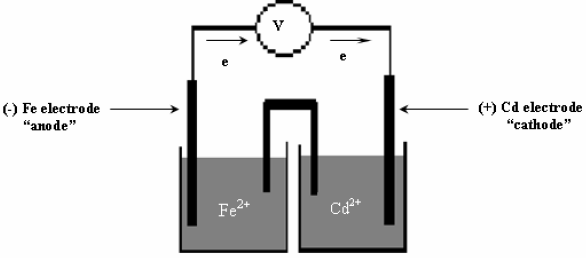
أرسم الخلیة الجلفانیة التي تمثل التفاعل التالي:
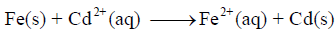
مبیناً على الرسم المصعد، والمھبط واتجاه حركة الإلكترونات ثم:
(أ) اكتب نصفي التفاعل ثم التفاعل كاملاً.
(ب) احسب جھد الخلیة القیاسي حيث :
EoFe = – 0.44 V , EoCd = – 0.40 V
الحل:
(أ) التصمیم بالشكل التالي یمثل رسماً لخلیة جلفانیة تتألف من قطبي كادمیوم وحدید.

مثال (9)
أرسم خلیة جلفانیة مكونة من قطب المغنسیوم (Mg) في محلول نترات الماغنسيوم (Mg (NO3)2) ، ومن قطب الرصاص في محلول نترات الرصاص pb(NO3)2 علماً بأن جهد الاختزال القياسي:
Eopb = – 0.13V
EoMg = – 2.37 V
EoMg = – 2.37 V
(أ) بین على الرسم اتجاه حركة الإلكترونات في الدائرة الخارجیة.
(ب) أكتب التفاعلات الحادثة عند كل قطب والتفاعل الكلي للخلیة.
(جـ) احسب الجھد القیاسي للخلیة.
الحل:
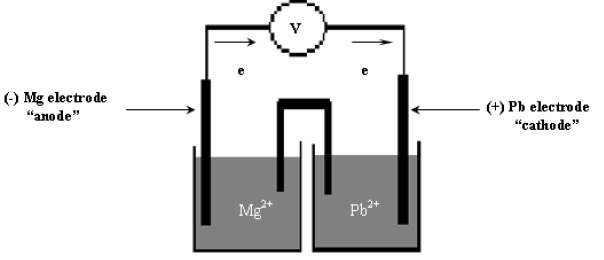

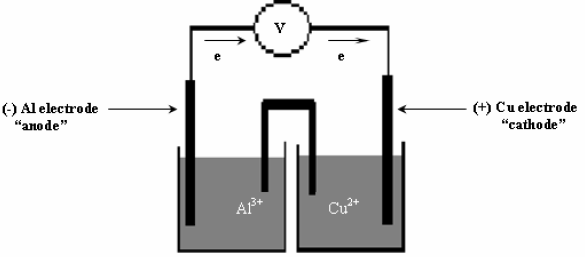
مثال (10)
(أ) ارسم الخلیة الجلفانیة التي تمثل التفاعل التالي:
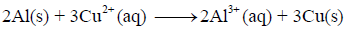
(ب) أكتب تفاعل نصف الأكسدة والاختزال.
(جـ) احسب جھد الخلیة القیاسي علماً بأن جھود الاختزال القیاسیة :
EoAl = – 1.66 V , EoCu = 0.34 V
الحل:
(أ)
(ب) التفاعل الكلي للخلیة:
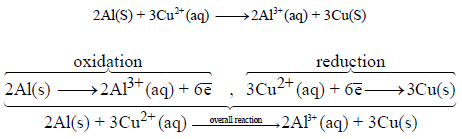
(جـ) حساب جھد الخلیة القیاسي:
يمكنك رؤية مسائل أكثر من موضوعات مختلفة فى الكيمياء خلال قسم اسئلة وإجابات فى موقعنا
لمزيد من الأسئلة والاجوبة في الكيمياء يمكنك الدخول إلى موقع اسألني كيمياء Ask-chemistry.com
المراجع: كتاب الكيمياء الكهربائية / د.عمر بن عبدالله الهزازي/ قسم الكيمياء-كلية العلوم التطبيقية – جامعة أم القرى/ المملكة العربية السعودية


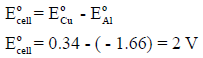






thanks