أسئلة وإجاباتالكيمياء العامة
السرعة الجزيئية Molecular Speed + مسائل محلولة

السرعة الجزيئية Molecular Speed (النظرية الحركية للغازات) + مسائل محلولة
السرعة الجزيئية Molecular Speed
– یجدر بنا أن نعتبر خاصیة جزیئیة ترتبط بطاقة الحركة وھي السرعات التي تتحرك بھا الجزیئات.
– تُعين السرعة الجزيئية من القانون الأتي:
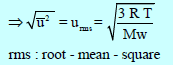
ويمكن استنتاج هذا القانون بعدة طرق:
الطريقة الأولي لاستنتاج قانون السرعة الجزيئية
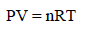
وتستنتج من النظریة الحركیة كما یلي:
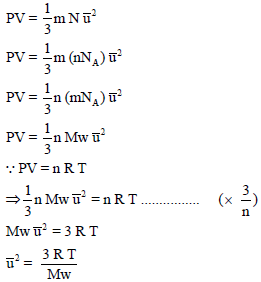
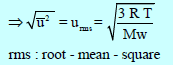
الطريقة الثانية لاستنتاج قانون السرعة الجزيئية
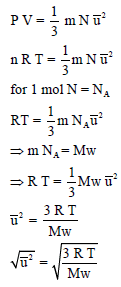
والطريقة الثالثة لاستنتاج قانون السرعة الجزيئية
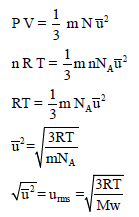
الطريقة الرابعة لاستنتاج قانون السرعة الجزيئية
من المعادلة:
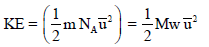
وبالربط بین ھذه النتیجة وفرض نظریة الحركة – الجزیئیة الذي ینص على أن:
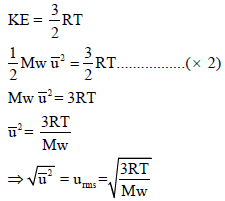
ملاحظات هامة
(1) قانون السرعة الجزيئية
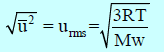
ویتم الحصول علیھا بأخذ الجذر التربیعي لمتوسط مربع جمیع السرعات الجزیئیة:
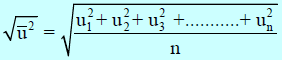
(2) العوامل التى تعتمد عليها السرعة الجزيئية
المعادلة:
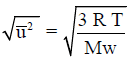
تدل على أن السرعة الجزیئیة تعتمد فقط على درجة الحرارة (T) وعلى طبيعة الغاز المستخدم الذي يميز بالوزن الجزيئي (Mw)
(3) وحدة قياس السرعة الجزيئية
لحساب الجذر التربیعي لمتوسط مربع السرعة بوحدة (m/s) يجب استخدام R بوحدة الجول، والوزن الجزيئي Mw يكون بوحدة Kg/mol وليس بوحدة Kg/mol
والسبب هو أن قيمة (R = 8.314 J/K.mol) والجول يساوي (1 J = 1 N.m) وحدته:
والسبب هو أن قيمة (R = 8.314 J/K.mol) والجول يساوي (1 J = 1 N.m) وحدته:
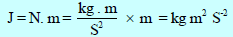
وبالتالي فإن:
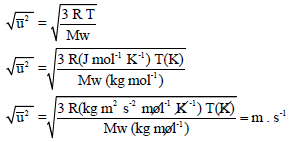
ولتحويل السرعة من وحدة m/s إلى وحدة Km/h نضرب:
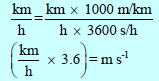
(4) العلاقة بين السرعة الجزيئية والوزن الجزيئي للغاز
متوسط مربع السرعة الجذري یتناسب عكسیاً مع الجذر التربیعي للوزن الجزیئي للغاز. فلو أن (Mw) معلومة یمكن حساب متوسط الجذر التربیعي للسرعة عند أي درجة حرارة حيث:
(R
= 8.314 J/K.mol , Mw = Kg/mol)
= 8.314 J/K.mol , Mw = Kg/mol)
ویمكن كتابة المعادلة:
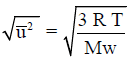
على هذه الصورة:
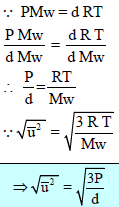
مثال توضيحي
في حالة غاز النيتروجين (N2) عند درجة حرارة (25Co) على سبيل المثال، فإن قيمة (Mw) وفقاً لنظام الوحدات العالمي (SI) تساوي 0.02802 وحيث أن العلاقة التحويلية للوحدات (1 J = 1 Kg m2 s-2) فتصبح السرعة المتوسطة:
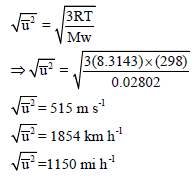
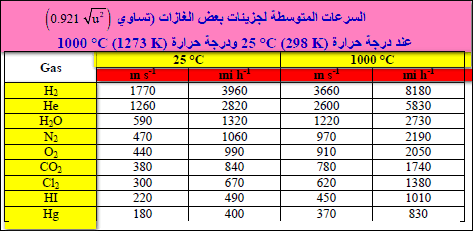
ویتضمن الجدول المثالي بعض قیم إضافیة للسرعة المتوسطة لعدد من الغازات ذات جزیئات بسیطة.
ویلاحظ أنه نظراً لأن طاقة الحركة المتوسطة عند درجة حرارة معینة لھا نفس القیمة لجمیع الجزیئات بغض النظر عن كتلھم فإن الجزیئات الخفیفة لھا سرعات أكبر من الجزیئات الثقیلة.
أمثلة محلولة على السرعة الجزيئية
مثال (1): احسب الجذر التربیعي لمتوسط السرعة لجزيء الھیدروجین (H2) عند درجة الصفر المئوي، علماً بأن الكتلة الذریة للھیدروجین (H = 1)
الحل:
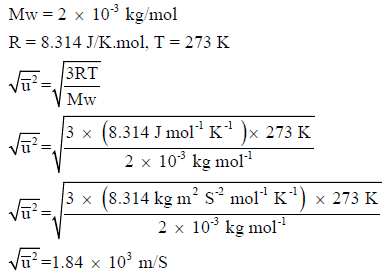
مثال (2): احسب درجة الحرارة لغاز النیتروجین (N2)عندما یكون الجذر التربیعي لمتوسط السرعة مساویاً لجزيء غاز الھیلیوم (He) عند درجة حرارة (27 Co)
علماً بأن الكتلة الذریة للھیدروجین (N = 14, He = 4).
الحل:
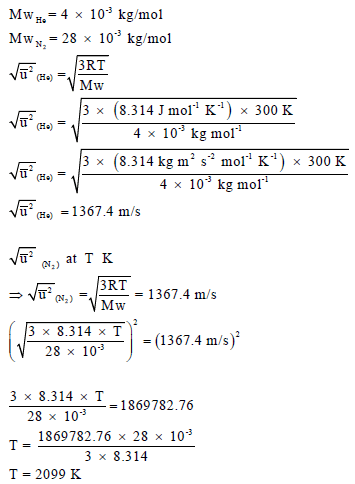
مثال (3): احسب الجذر التربیعي لمتوسط مربع السرعة لجزيء الھیدروجین عند درجة الصفر المئوي (R = 8.314 J/K.mol)
علماً بأن الكتلة الذریة لجزئ لھیدروجین (H2 = 2.016).
الحل:
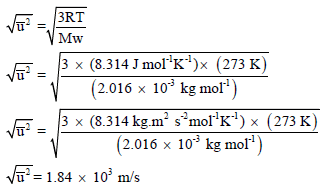
ولتحويل من الوحدة m/s إلى Km/h
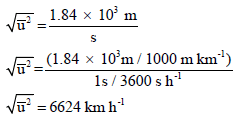
وباختصار لتحويل السرعة من الوحدة m/s إلى Km/h نضرب:
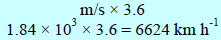
عند درجة الصفر المئوي تبلغ سرعة جزيء غاز H2(6624 Km/h) هي ومع ذلك فعند ملاحظة انتشار غاز في غاز آخر فإن الانتشار لا یتم بتلك السرعة ، ویرجع السبب في ذلك أنه بالرغم من سرعة الجزيء العالیة إلا أنه یغیر اتجاھه باستمرار نتیجة اصطدامه بالجزیئات الأخرى.
مثال (4): احسب الجذر التربیعي لمتوسط مربع السرعة الجزیئیة عند الظروف القیاسیة لـ (0.1 mol) من غاز الأكسجين.
الحل:

ولتحويل من الوحدة m/s إلى Km/h

وباختصار
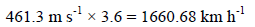
مثال (5): احسب الجذر التربیعي لمتوسط مربع السرعة لجزیئات غاز النیتروجین (N2) عند (273 K) بوحدة Km/h
الحل:

ولتحويل من الوحدة m/s إلى Km/h
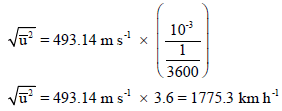
المراجع
– أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية