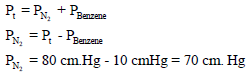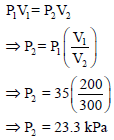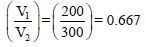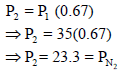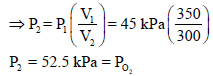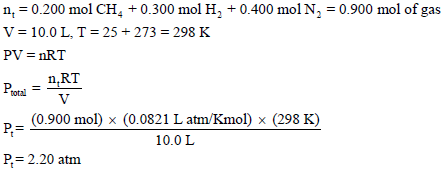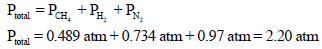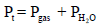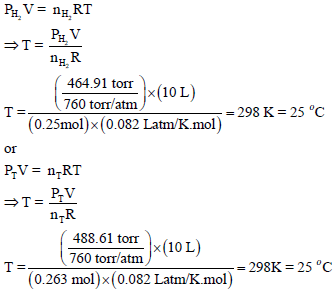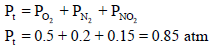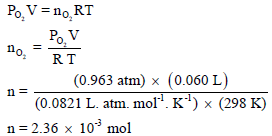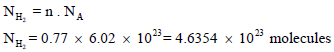مسائل على قانون دالتون Dalton Law للضغوط الجزيئية (الجزء الثاني)
كنا قد تناولنا في الدرس السابق مجموعة من المسائل المحلولة عن قانون دالتون للضغوط الجزيئية Dalton Law وعددها 11 مسألة مع الحلول وفى هذا الدرس سوف نكمل مسائل أخري بأفكار مختلفة حيث يمكنك مراجعة الدروس الأتية بالضغط عليها مباشرة:
(1) شرح قانون دالتون للضغوط الجزيئية Dalton Law of Partial Pressures
(2) مسائل محلولة على قانون دالتون Dalton Law للضغوط الجزيئية (الجزء الأول).
أما الآن دعونا نكمل باقي المسائل.
مثال (12): قانون دالتون Dalton Law
مخلوط يتكون من (32 g) من الأكسجين (O2) و (112 g) من النيتروجين (N2) وضغطه الكلي (1 atm) احسب الضغط الجزئي للأكسجين.
الحل:
نحسب أولاً عدد المولات لكل غاز، ثم نوجد الكسر المولي ومنه نوجد الضغط الجزئي لكل غاز كما یلي:
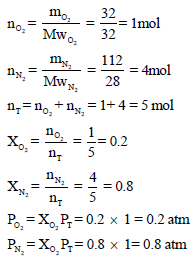
ملحوظة هامة جداً
فإذا كان الضغط الجزئي للنيتروجين 25 KPa ، وللأكسجين 35KPa ولثاني أكسيد الكربون 45 KPa فيكون الضغط الكلي للمزيج:
یمكن الإستفادة من قانون دالتون في تحدید الضغط الناتج عن مزج غازین كانا أصلاً في أوعیة منفصلة.
مثال (13): قانون دالتون Dalton Law
إذا تم مزج (200 cm3) من N2 عند (25 Co) وضغط (35 KPa) مع (350 cm3) من O2 عند (25 Co) وضغط (45 KPa) بحيث أن الحجم الناتج يساوي 300 cm3 فماذا یكون الضغط النهائي للمزیج عند درجة 25 Co؟
الحل:
من قانون دالتون یمكن معاملة كل غاز في المزیج كما لو كان ھو الغاز الوحید الموجود، لذا نستطیع أن نحسب بشكل مستقل الضغوط الجدیدة لكل منN2 , O2 عند وضعھما في الوعاء سعته (300 cm3) ، وبسبب أن درجة الحرارة ثابتة فإن القانون المتبع ھو قانون بویل:
ونلاحظ أن الحجم قد زاد من (200 cm3) إلى (300 cm3) وبالتالي فإن الضغط (P1) سيقل إلى (P2)
ومن هنا لكي يكون: P1 > P2 فإن P1 تضرب في نسبة حجم اقل من الواحد وهي كما یلي::
وبالتالي فإن:
ثانياً: حساب ضغط الأكسجين P2 وفقاً لقانون بویل كما یلي:
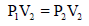
يلاحظ أن حجم O2 انخفض من 350 cm3 إلى 300 cm3 لذلك فأن الضغط P1 سيرتفع ، ولكي یرتفع لا بد من ضربة بنسبة حجم أكبر من الواحد:
ولحساب الضغط الكلي للمزیج نجمع الضغوط الجزئیة :
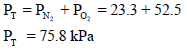
مثال (14): قانون دالتون Dalton Law
لدیك قنینة حجمھا (10 L) تحوي (0.200 mol) من الميثان (0.300 mol) من الهيدروجين (0.400 mol) من النيتروجين عند (25 Co).
(أ) ما الضغط الجوي داخل القنينة؟
(ب) ما الضغط الجزئي لكل مكون من خلیط الغازات؟
(ب) الضغط الجزئي لكل غاز في الخلیط یمكن أن یحسب بإحلال عدد مولات كل غاز في المعادلة PV = nRT كل على حدة، وهذا يعني أن:
والضغط الكلي Pt يعطى بالعلاقة:
مثال (15): قانون دالتون Dalton Law
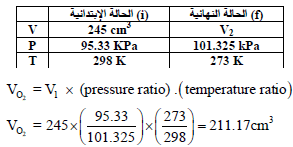
قام طالب بتولید غاز الأكسجين في المختبر، وتجمیعه بطريقة إزاحة الماء عند درجة حرارة (25Co) إلى أن أصبح مستوى الماء داخل الدورق وخارجه متساوياً، فإذا كان حجم الغاز 245 cm3 والضغط الجوي 98.5 Kpa
(أ) ما هو الضغط الجزئي لغاز O2 في مزيج الغاز الرطب عند 25 Co ، إذا علمت أن ضغط بخار الماء عند (25 Co) هو 3.17 KPa
(ب) ما هو حجم الأكسجين الجاف عند (STP)؟
والغاز هو الأكسجين:
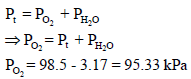
(ب) لحساب VO2 عند STP (P = 101.325 kPa, T = 273 K):
مثال (16)
وضع شریط من المغنسیوم في كمیة من الماء وأضیف إلیھا كمیة من حمض HCl وتصاعد الھیدروجین نتیجة للتفاعل التالي:
ثم جمع الھیدروجین من على سطح الماء في إناء حجمه (10 L) فإذا كانت كمیة المغنسیوم المستخدمة تؤدي الى تصاعد (0.5 g) من الھیدروجین وكان الضغط المقاس في الإناء یساوي (488.61 torr) عند درجة حرارة التجربة.
(أ) احسب عدد مولات الھیدروجین (علماً بأن الكتلة الذریة Aw=1)
(ب) احسب الضغط الجزئي للھیدروجین إذا علمت أن ضغط بخار الماء یبلغ عند ھذه الدرجة من الحرارة (22.76 torr).
(جـ) حساب الكسر المولي للماء وللھیدروجین
(د) حساب عدد المولات الكلي nt
(هـ) احسب كمیة بخار الماء التي صاحبت عملیة التجمیع.
(و) احسب درجة حرارة التجربة.
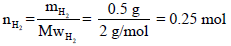
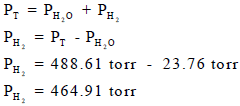
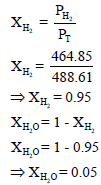
عدد المولات الكلي یقتضي معرفة عدد مولات الھیدروجین nH2 وعدد مولات بخار الماء (nH2O)
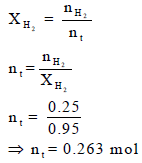
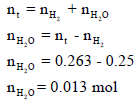
ھناك ثلاث قوانین یمكن أن تستخدم لحساب درجة الحرارة وكلھا تختلف فقط في تطبيق نوع المولات كما یلي:
مثال (17)
مخلوط من غازات یحتوي على (0.5 atm) من O2 مع (0.2 atm) من N2 مع (0.15 atm) من NO2 فما ضغط المزيج؟
مثال (18)
تم جمع (60 ml) من غاز الأكسجین فوق الماء وكان ضغطه المقاس ھو755torr عند درجة حرارة 25 Co فإذا كان ضغط بخار الماء عند نفس درجة الحرارة ھو 24 torr فاحسب عدد المولات المتجمعة من الأكسجین؟
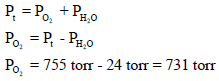

مثال (19)
خزان مملوء بالهيدروجين H2 فوق الماء حجمه 20 L ويبلغ ضغطه74.7 cmHg في درجة حرارة 27 Co احسب وزن وعدد جزیئات الھیدروجین إذا علمت أن ضغط بخار الماء عند نفس الدرجة یساوي 2.7 cm Hg ؟
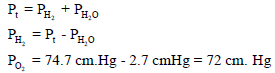
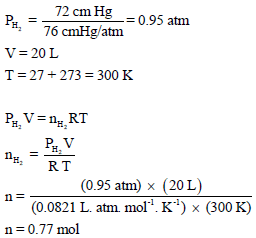
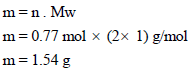
مثال (20)
عند جمع غاز النیتروجین فوق زجاجة مقلوبة فوق سطح البنزین عند درجة حرارة 26 Co كان الضغط داخل الزجاجة 80 cm Hg والحجم 225 ml ، احسب الضغط الجزئي للنیتروجین. علماً بأن ضغط بخار البنزین عند 26 Co يساوي 10 cm Hg ، ثم احسب وزن غاز النیتروجین؟