أسئلة وإجاباتالكيمياء العامة
مسائل محلولة على معادلة فان درفالز للغاز الحقيقي وقانون الغاز المثالي
مثال (1)
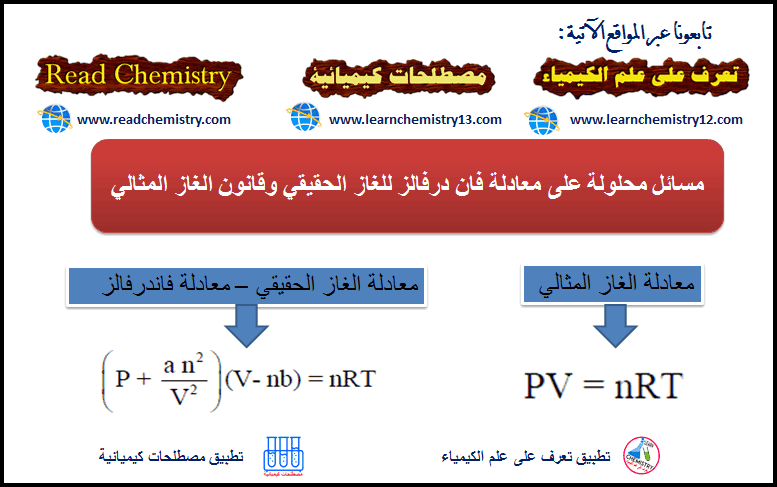
احسب الضغط الذي یؤدیه mol 1.0 من بخار الماء في حجم قدره 20.0 L عند Co 27.0 باستخدام:
(أ) قانون الغاز المثالي
(ب) معادلة فان درفالز:
الحل:
(أ) باستخدام قانون الغاز المثالي:
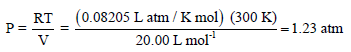
(ب) معادلة فان درفالز:
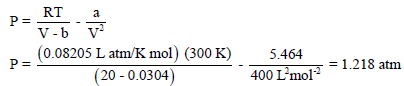
مثال (2)
احسب الضغط المتكون من6 mol من أول أكسيد الكربون (CO) في وعاء حجمه (3 L) عند (25 Co)
قارن بين هذه القيمة مع تلك المتوقعة لغاز المثالي.
قارن بين هذه القيمة مع تلك المتوقعة لغاز المثالي.
علماً بأن : (R = 0.0821 L. atm K-1 mol-1)
وثوابت فاندرفالز هي : (a = 1.49 atm.L2 mol-2, b = 0.0399 L/mol2)
الحل:
نحسب أولاً : ضغط الغاز باعتباره مثالیاً:

ثانیاً / نحسب ضغط الغاز باعتباره غازاً حقیقیاً بتطبیق معادلة فان درفالز:
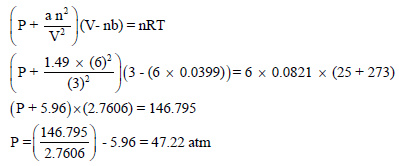
ونلاحظ أن قیمة الضغط في حالة الغاز المثالي (48.932 atm) أعلى منها في حالة الغاز الحقيقي (47.22 atm) والسبب في ذلك أن قوى التجاذب بین جزیئات الغاز المثالي مھملة بینما ھي معتبرة في حالة الغاز الحقیقي.
مثال (3)
احسب الضغط الناتج عن 3g من الهيدروجين H2 في وعاء حجمه 225cm3 عند درجة حرارة 0 Co
(أ) باعتبار الھیدروجین غازاً مثالیاً.
(ب) باعتبار الھیدروجین غازاً حقیقیاً.
علماً بأن : (R = 0.0821 L. atm/ K. mol)
وثوابت فاندرفالز هي : ( a = 0.072 L2. atm/mol2. b = 0.244 L/mol2) والكتلة الذریة للھیدروجین = 1
الحل:
(أ) حساب ضغط غاز الھیدروجین باعتباره غازاً مثالیاً بتطبیق العلاقة:
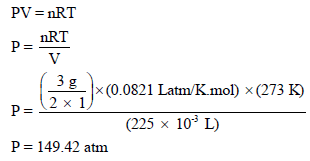
(ب) حساب ضغط غاز الھیدروجین باعتباره غازاً حقیقیاً وذلك بتطبیق معادلة فان در فالز:
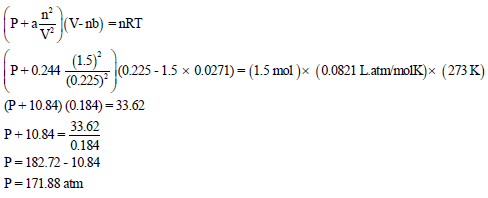
مثال (4)
ما الغاز فیما یلي الذي له قیمة ثابت (b) أكبر في معادلة فان درفالز للغازات الحقيقة:
(أ) He
(ب) CH4
(جـ) C2H2
(د) C3H8
الحل:
الثابت (b) في معادلة فان درفالز للغازات الحقیقیة یعبر عن الحجم الذاتي لمول من جزئيات الغاز.
وبالتالي فكلما زاد عدد الذرات في الجزيء تزداد قیمة (b) للغاز ، وبناءاً عليه فأن غاز البروبان C3H8 له أعلى قيمة (b)
مثال (5)
احسب الضغط الذي سيمارسه (2mol) من غاز النيتروجين (N2) في حجم قدره (1 L) عند (0 Co) باستخدام:
(أ) قانون الغاز المثالي
(ب) قانون الغاز الحقيقي
(معادلة فان درفالز) علماً بأن a = 1.39 atm.L2 mol-2, b = 0.0391L mol-2, R= 0.0821) )
(معادلة فان درفالز) علماً بأن a = 1.39 atm.L2 mol-2, b = 0.0391L mol-2, R= 0.0821) )
الحل:
(أ) ضغط الغاز المثالي وفقاً للقانون العام للغازات المثالیة (PV = n R T) يساوي:
P (ideal gas) = 44.827 atm
(ب) ضغط الغاز الحقیقي (وفقاً لقانون فان در فالز):
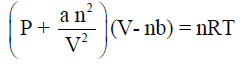
يساوي P(real gas) = 43.07 atm
ونلاحظ أن ضغط الغاز المثالي أكبر من ضغط الغاز الحقیقي لأنه في المثالي أھملت قوى التجاذب بین الجزیئات بینما أقرت في الغاز الحقیقي.
مثال (6)
لدیك ثلاثة غازات خلطت في إناء سعته(10 L) لتعي ضغطاً كلياً قدره (800 mmHg) عند (30 Co) فإذا احتوى المخلوط على (8 g) من غاز (CO2) و (6 g) من غاز (O2) وكمية مجهولة من غاز N2 احسب الضغط الجزئي لغاز النيتروجين N2 باستخدام قانون الغاز المثالي ثم باستخدام قانون فان درفالز للغاز الحقیقي. علماً بأن:
الكتل الذرية : (C = 12, N = 14, O = 16) (R = 0.0821 L. atm K-1 mol-1)
( a = 2.5 atm L2 mol-2, b = 0.032 L mol-2 )
الحل:
أولاً / نحسب عدد المولات لغازي (CO2 , O2) كما يلي:
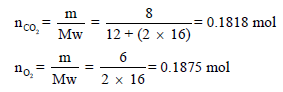
ثانیاً/ بما أن الضغط الكلي معروف فإنه یمكن حساب عدد المولات الكلي :(nt)
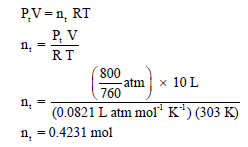
ثالثاً / نحسب عدد مولات غاز النيتروجين من عدد المولات الكلي:
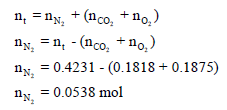
رابعاً/ حساب الضغط الجزئي لغاز النيتروجين من القانون العام للغازات المثالیة:
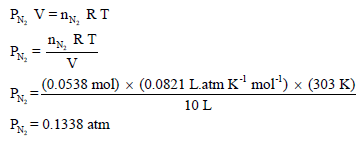
خامساً / حساب الضغط الجزئي لغاز النيتروجين باستخدام معادلة فان درفالز:
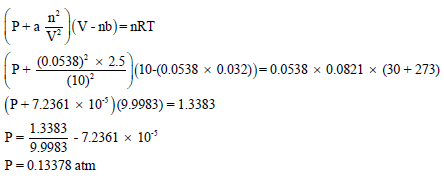
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.







مرحبا اذا طلب من عدنا إيجاد حجم بدلا من الضغط بطريقه فاندر فالز ياريت اسئله ع هيج شي