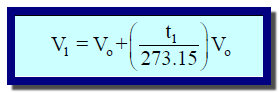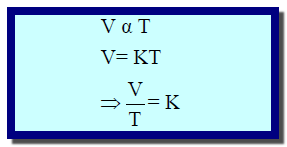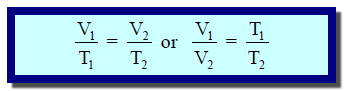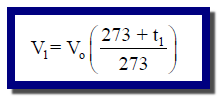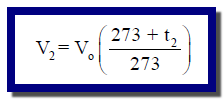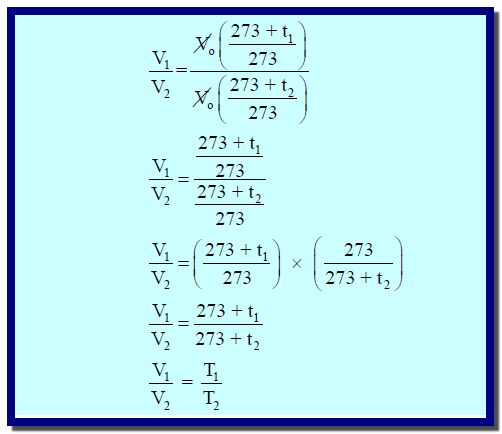قانون شارل للغازات Charle’s Law من الاكتشاف حتى الصيغة النهائية
بداية اكتشاف قانون شارل Charle’s Law
– مضى أكثر من قرن زمني على اكتشاف العلاقة المناظرة لقانون بویل (قانون شارل). وھي العلاقة بین حجم الغاز (V) ودرجة الحرارة (T). ویرجع السبب في طول تلك الفترة التاریخیة إلى صعوبة إدراك مفھوم درجة الحرارة إذا ما قورن بمفھوم الضغط.
– وعلى الرغم من أنه یمكن إدراك الفروق بین البارد والساخن إلا أن الطرق اللازمة للتقدیر الكمي (لدرجة الحرارة (لم تكن سھلة الابتكار.
– وعلى كل فقبیل نھایة القرن الثامن عشر أصبحت طریقة قیاس درجة الحرارة بواسطة استخدام تمدد سائل في أنبوبة زجاجیة (مثل الثرمومتر الحالي) طریقة مقبولة لقیاس درجة الحرارة.
– وبالإضافة إلى ذلك فقد اتفق في قارة أوروبا على مقیاس لدرجة الحرارة تمثل فیه درجة الصفر بنقطة تجمد الماء ودرجة المائة بنقطة غلیان الماء عند الضغط الجوي.
– كما أتاح وجود الثرمومترات والاتفاق على قیاس درجات الحرارة الفرصة لدراسة التغیر في حجم الغاز مع التغیر في درجة الحرارة.
– ومن الملاحظ أن جمیع المواد تتمدد عند تسخینھا ، ویتفاوت مقدار التمدد من مادة لأخرى. ویتعرض الھواء الجوي وجمیع الغازات الأخرى عند تسخینھا (عند ضغط ثابت) لتغیرات كبیرة في الحجم (تتمدد حراریاً(
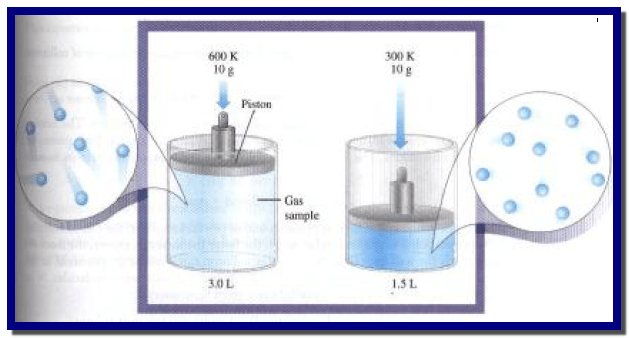
– ویمكن عملیاً قیاس الزیادة في الحجم بزیادة درجة الحرارة، وذلك بحبس كمیة ثابتة لغاز في اسطوانة مزودة بمكبس منزلق كما في الشكل وحیث أن الكتلة فوق قمة المكبس ثابتة، فإن العینة من الغاز تبقى عند ضغط ثابت.
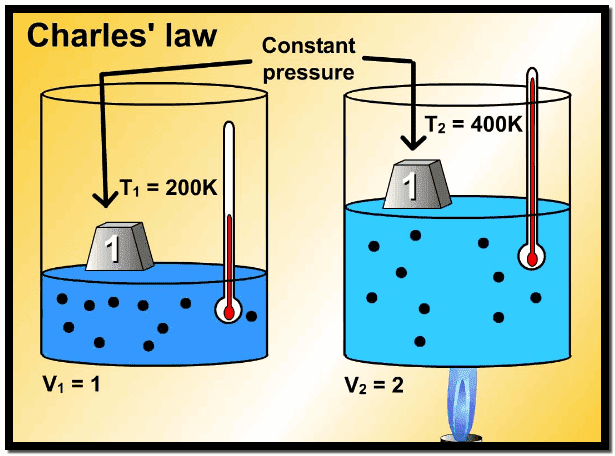
– ویلاحظ أنه كلما سخن الغاز، فإن المكبس یتحرك للخارج، ویزداد الحجم.
دراسة تأثير التغير في درجة الحرارة على حجم الغاز عند ضغط ثابت.
– ولقد درس العالم الكیمیائي الفرنسي جاك الكسندر تشارلز Jacques Alexander Charles عام 1787م. وكان رائد البالونات في ذلك الوقت ، وكذلك درس جاي لوساك Gay-Lussacفي نفس الفترة (تأثير التغير في درجة الحرارة على حجم كمية معينة من الغاز موضوعة عند ضغط ثابت).
– فوجد أنه إذا تم تسخین غاز بحیث أن الضغط یبقى ثابتاً، یتمدد الغاز (یزید حجمه). وأن معدل التمدد مع زيادة درجة الحرارة كان ثابتاً وكان نفسه لجمیع الغازات التي درسها مادام الضغط ثابتاً. وهذا الاكتشاف لم یمیز حتى قریباً من القرن الماضي.
– وقد أجرى العالمان تشارلز Charles وجاي لوساك Gay-Lussacدراسات كمیة على ھذا السلوك للغازات انتھت بما یعرف الآن بقانون تشارلز حیث أوضحت دراستھما أنه: (عند الضغط الثابت فإن حجم عینة من الغاز یتمدد بالتسخین وینكمش بالتبرید).
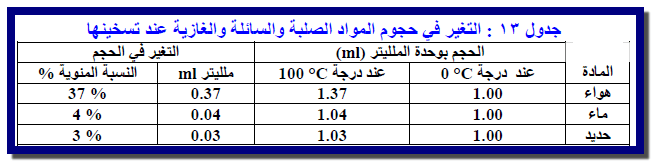
– وبصفة خاصة فإن الغازات تتمدد أكثر من المادة الصلبة أو السائلة. أما التمدد الحراري الذي تتعرض له المواد الصلبة والسائلة، فیمكن إھمالها في كثیر من الأحیان لأنه یسبب زیادة بسیطة في الحجم كما یتضح من الجدول التالي الذي یقارن الزیادة في حجم 1ml من كل من الھواء والماء والحدید عند التسخین من درجة صفر مئوي إلى درجة 100 Coتحت ضغط جوي.
نص قانون شارل Charle’s Law
– أن علاقة حجم الغاز ودرجة الحرارة التى تم دراستها من قبل العالم الفرنسي تشارلز 1787م، وطورها العالم جاي لوساك في عام 1802م تبين العلاقة بين الحجم ودرجة الحرارة للغازات.
– وتنص هذه العلاقة على أنه:
(عند ضغط ثابت، یزداد (أو یقل) حجم كمیة معینة من أي غاز بمقدار ثابت (1/273.15) من حجمھا عند درجة الصفر المئوي كلما ازدادت (أو قلت) درجة حرارة الغاز بمقدار درجة مئویة واحدة).
الصیغة الریاضیة لقانون شارل Charle’s Law
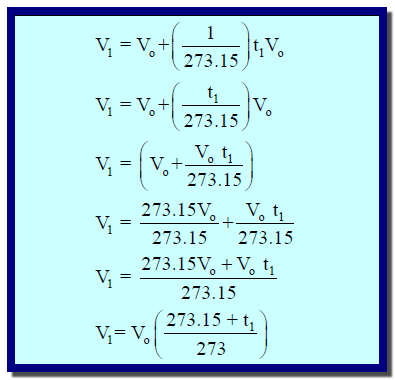
وفى العلاقة التالية :
– المقدار V0(t1/273.15) : یعبر عن مقدار التغیر في الحجم (زیادة بزیادة درجة الحرارة، أو نقصاً بنقصان درجة الحرارة).
– المقدار (1/273.15) : يعرف بمعامل التمدد الحراري الحجمى.
– حيث وجد أن العديد من الغازات مثل الأكسجين O2 والنيتروجين N2 والهيليوم He والنشادر NH3 وثاني أكسيد الكربون CO2 وثاني أكسيد الكبريت SO2 والآرجون Ar لها نفس معامل التمدد الحجمى الحراري أي (1/273.15)
– للتبسيط فى حساباتنا سوف نستخدم الرقم (273) بدلاً من (1/273.15) وإهمال الرقم العشري الصغير (0.15)
العلاقة البيانية لقانون شارل Charle’s Law
– من العلاقة :
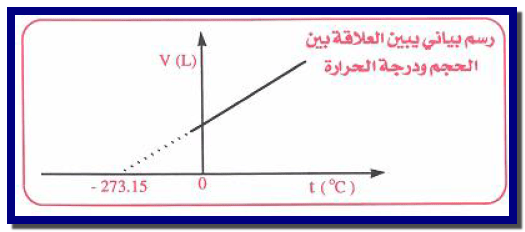
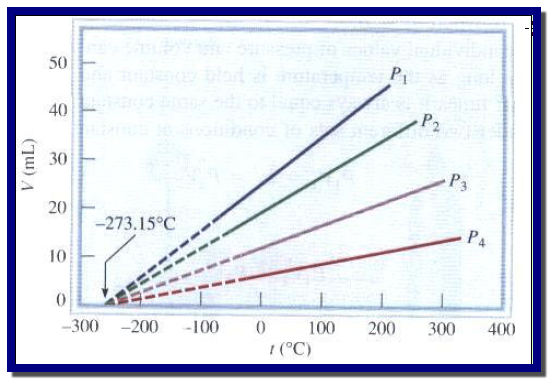
– هي علاقة خط مستقيم حيث يرسم (V1) على محور الصادات و (t) على محور السينات. وبالتالي فإن حجم كمیة ثابتة من الغاز عند ضغط ثابت یزداد بشكل خطي مع ازدیاد درجة الحرارة.
– حیث تقع النقط على خط مستقیم، موضحة أن الحجم یتغیر خطیاً (linearly) مع درجة الحرارة.
– وإذا خفضت درجة الحرارة بمقدار كاف، فإن الغاز یتكثف، ولا یمكن الحصول على أي نقط تجریبیة.
– وإذا مد الخط المستقیم، أو بالاستكمال، نحو درجات حرارة أدنى، كما ھو مبین بالخط المتقطع، فإنه یصل نقطة لحجم قدره الصفر.
– ودرجة الحرارة التي یصل عندھا الخط المتقطع حجماً قدره الصفر ھي (-273 Co) بصرف النظر عن نوع الغاز المستعمل، أو الضغط الذي تجرى عنده التجربة.
– ويشار إلى النقطة (-273 Co)بالصفر المطلق (0 K) نظراً لأن درجات الحرارة الأدنى من ذلك سوف ترادف حجماً سالباً.
الصفر المطلق Absolute Zero
– نرى من الرسم أن الخط المستقیم الذي یمثل العلاقة بین درجة الحرارة والحجم لو امتد على استقامته(-273.15 °C) لتقاطع مع خط درجة الحرارة عند الدرجة. والشيء الملفت للنظر أن ھذا التصرف نفسه یلاحظ في أي غاز.
– وتمثل هذه النقطة درجة الحرارة التي یكون لكل غاز عندھا حجم يساوي الصفر V=0 إذا لم تتكثف أو یكون لھا حجم سالب عند درجات حرارة أقل. وبما أن الحجوم السالبة غیر معقولة، فیجب أن تمثل أقل درجة حرارة ممكنة و تدعى درجة الصفر .(Absolute Zero
– عند ھذه الدرجة التي یفترض أن یكون عندھا حجم الغاز یساوي صفراً. (من الناحیة النظریة ولكن ھذا لا یحدث في الواقع العملي حیث من المستحیل وفقاً لقانون التحویل الكتلي الذي ینص على أن الكتلة لا یمكن تحطیمھا أو تخلیقھا). إضافة الى ذلك فإن الغازات تتم إسالتھا قبل ذلك وأحیاناً تتحول الى الحالة الصلبة (
– استخدم العلماء هذا السلوك للغازات كأساس لمقياس حرارة جديد مقياس الحرارة المطلقة (مقياس كيلفن)
– حيث لاحظ اللورد كيلفن 1848م ، فيزيائي بريطاني، أنه عند مد خطوط مختلفة الحجم والحرارة تعود الى الحجم zero ينتج تقاطع مشترك وهذا التقاطع هو (-273.15) .
– وحدد كيلفن درجة الحرارة (-273.15) على أنها أقل درجة حرارة يمكن بلوغها نظرياً وسميت بالصفر المطلق .
– وتكريماً للعالم كيلفن سمي هذا المقياس الحراري بمقياس درجة الحرارة كيلفن. ويكون مقداره كما يلي:
T = t + 273.15
حيث: T = درجة الحرارة بالكلفن ، t = درجة الحرارة المئوية
– لذلك يمكن وضع تعريف للصفر المطلق وهو درجة الحرارة التي ينعدم فيها حجم الغاز المثالي. وهي تساوي (-273.15 °C)
قانون شارل الجديد
– بعد اكتشاف تدريج درجة الحرارة المطلقة يمكن استنباط علاقة بين الحجم (V) ودرجة الحرارة (T) على نمط قانون بويل حيث وجد أن :
– تعرف النتیجة السابقة بقانون جاي لوساك الذي طورھا، كما تسمي أحیاناً بقانون تشارلز لأنه ھو الذي ابتدأھا. وتنص ھذه النتیجة على أنه:
(عند ثبوت الضغط یتناسب حجم كمیة معینة من غاز ما تناسباً طردیاً مع درجة الحرارة المطلقة).
The volume of a fixed amount of gas at constant pressure is directly proportional to the absolute temperature
– وفي كثیر من الأحیان نتعامل مع حجم كتلة معلومة من غاز عند درجتین مختلفتین من الحرارة. لذلك یمكننا استخدام العلاقة العامة للحجم ودرجة الحرارة للغاز المثالي عند ثبوت الضغط في صورتھا كما يلي:
وھذه العلاقة صحیحة فقط عندما یعبر عن درجة الحرارة بالمقیاس المطلق.
كيفية استنتاج قانون شارل الجديد من قانون شارل القديم
إستنتاج القانون:
عند درجة حرارة (t1) يكون القانون كما يلي:
الحيود عن قانون شارل
مسائل محلولة على قانـون شارل
للأمثلة والتمارين على قانون شارل فقد خصصنا موضوع كامل عن هذا الأمر : أضغط هنا
المراجع: أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية