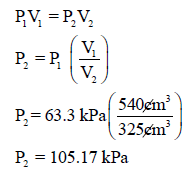قانون بويل للغازات Boyle’s Law
قوانين الغازات The Gas Laws
– وتختلف الحالة الغازية عن كلا من الحالة الصلبة والحالة السائلة من وجوه عدة منها على سبيل المثال أن الغاز يتمدد فجأة ليملأ الإناء الذي يحتويه وبالتالي فإن حجم الغاز يساوى حجم الإناء الحاوي له، أيضا فإن قابلية الغازات للانضغاط مرتفعة جداً فعندما يطبق ضغط على الغاز فإن حجمه يقل بطريقة ملحوظة، على عكس المواد الصلبة والسائلة فأنها لا تتمدد لتملأ الإناء كما أنها تقريبا غير قابلة للانضغاط.
– التجارب التي تمت على كثير من الغازات بينت أنه توجد أربع متغيرات نحن في حاجة إليها لكي نعرف حالة الغاز أو الظروف الفيزيائية له وهي:
- درجة الحرارة (T) Temperature
- الضغط (P) Pressure
- الحجم (V) Volume
- كمية الغاز معبرا عنها بالمولات (n) moles
والمعادلات التي تعبر عن العلاقة بين هذه المتغيرات الأربع تعرف بـ (قوانين الغازات).
وسوف نشرح كل قانون من تلك القوانين في درس منفصل ولكن في هذا الدرس سوف نشرح قانون بويل .
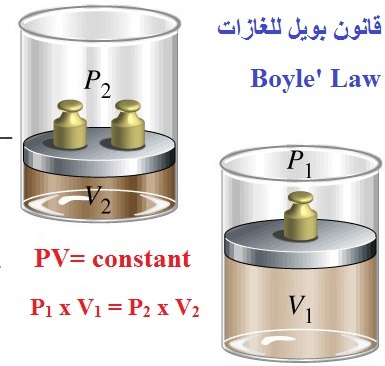
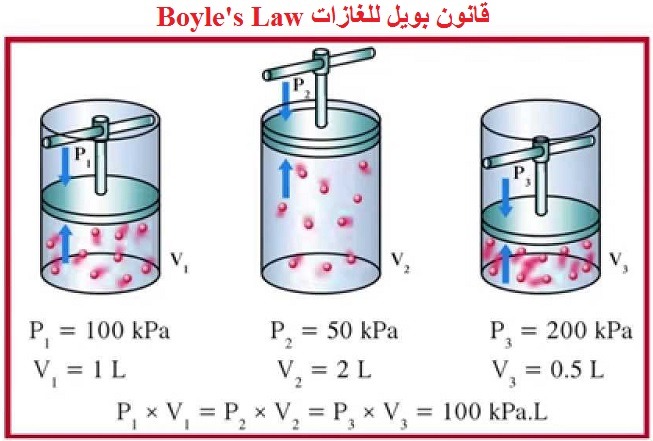
قانون بويل للغازات Boyle’s Law
وينص على: (حجم كمية معينة من غاز محفوظ عند درجة حرارة ثابتة يتناسب عكسيا مع الضغط)
تمثل العلاقة بين الضغط والحجم عند ثبوت درجة الحرارة كما بالمعادلات التالية:
V= constant× 1/P
or PV= constant
P1 x V1 = P2 x V2
وقيمة الثابت تعتمد على درجة الحرارة وكمية الغاز.
 |
| قانون بويل للغازات |
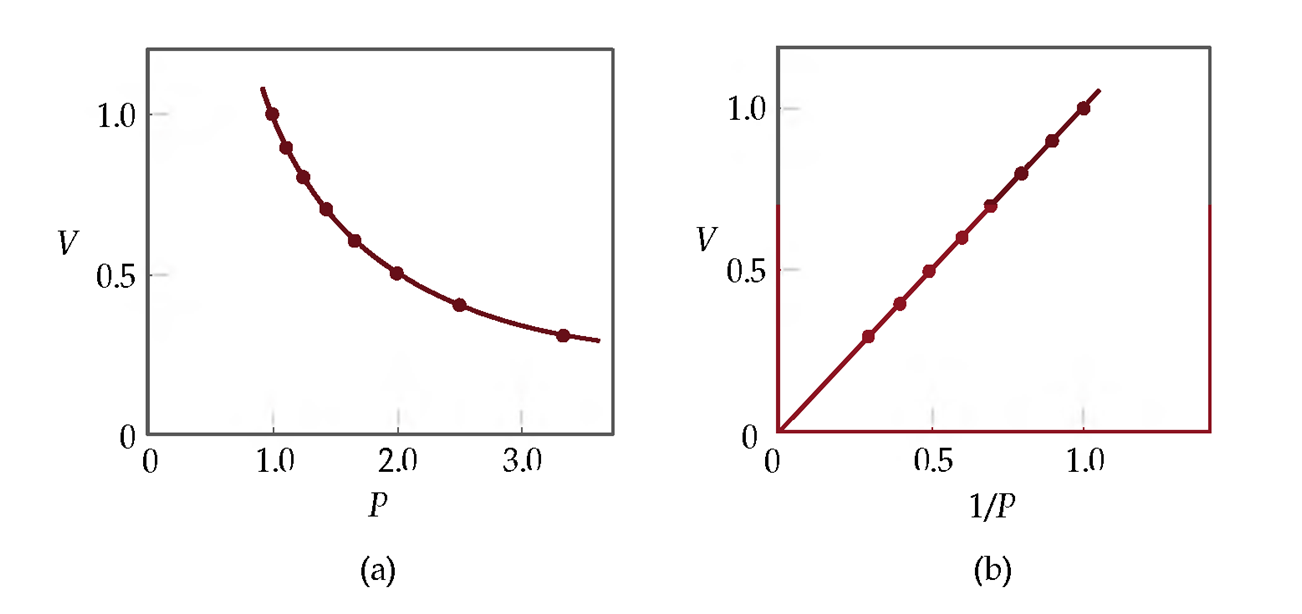
العلاقة البيانية لقانون بويل
يوضح العلاقة بين الحجم والضغط لكمية معلومة من غاز عند درجة حرارة ثابتة حيث تظهر العلاقة عبارة عن منحنى، أما برسم العلاقة بين الحجم ومقلوب الضغط فتظهر العلاقة على شكل خط مستقيم يمر بنقطة، كما بالأشكال التالية:
 |
| العلاقة البيانية لقانون بويل |
مسائل محلولة على قانون بويل
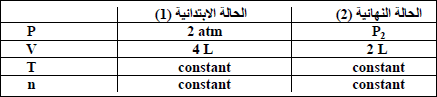
مثال (1): یبلغ ضغط كمیة معینة من غاز في إناء حجمه (4 L) مقدار (2 atm) عند (0 oC) فكم يبلغ ضغط نفس الكمية عند نفس درجة الحرارة إذا وضعت في إناء حجمه (2 L)؟
الحل:
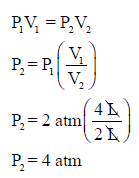
مثال (2): عینة من غاز مثالي، فإذا كان حجمه (5 L) تحت ضغط قدره (15 atm) فاحسب حجم هذا الغاز إذا صار ضغطه (3 atm) ، باعتبار درجة الحرارة ثابتة؟
الحل:
یمكن حل ھذه المسألة بقانون بویل مباشرة كما یلي:
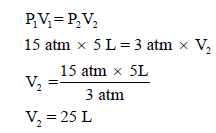
مثال (3): (2 L) من غاز الأكسجين (O2) تحت ضغط (670 mmHg) كتلته (1.42 g) (افرض عدم التغير في درجة الحرارة). ما كثافة الغاز بوحدة g/L إذا زاد الضغط إلى (8 atm)؟
الحل:
في ھذا السؤال كانت وحدة الضغط الابتدائي ھي (mmHg) ووحدة الضغط النهائي هي (atm) ، ولتطبیق قیم الضغط الابتدائية (P1) ، والنهائية (P2) فإنه لابد وأن يكون لھا نفس الوحدة، لذلك لا بد أن تكون وحدة الضغط إما (atm) ، (mmHg) ، وبأخذ الوحدة (atm) لذلك نحول القيمة (760 mmHg) إلى وحدة (atm) حيث أن العلاقة بينهما:
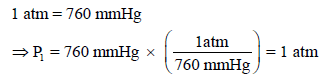
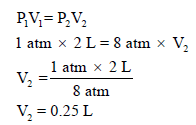
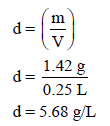
مثال (4): أسطوانة مكبس متحرك تحتوي على (540 cm3) من غاز الأكسجين تحت ضغط يساوي (63.3 kPa) فإذا تحرك المكبس حتى أصبح حجم نفس الكتلة (325 cm3) فاحسب الضغط النهائي داخل الأسطوانة؟
الحل:
بتطبيق قانون بوبل: