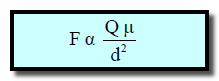قوى التجاذب بين أيون وجزيء ثنائي القطب
– هناك قوى تجاذب بين جزئيات السائل ، وهذه القوى أضعف بكثير من الرابطة التساھمیة التي تربط بین الذرات في الجزيء، فمثلاً الطاقة اللازمة لتبخیر السائل (إبعاد الجزیئات بعضھا عن بعض) أقل بكثیر من الطاقة اللازمة لتكسیر الروابط في جزیئات السائل، ولكن في هذا الدرس سوف نشرح قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole Attractive Forces.
محتويات الموضوع
أنواع قوى التجاذب بين الجزيئات Types of Intermolecular Attractive Forces
(1) قوى ثنائي القطب – ثنائي القطب Dipole-Dipole Attractive Forces
(2) قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole AttractiveForces
(3) قوى التجاذب بين أيون وجزيء قطبي مستحث Ion-Induced DipoleAttractive Forces
(4) الرابطة الهيدروجينية Hydrogen Bond
(5) قوى لندن التشتتية LondonDispersion Forces ( قوى فان درفالز)
– وكنا قد شرحنا في الموضوعات السابقة كل نوع على حدا بطريقة مفصلة (اضغط على الموضوع الذى تريد قرأته ليتم تحويلك إلى الموضوع) ولكن في هذا الدرس سوف نشرح قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole Attractive Forces.
قوى التجاذب بين أيون وجزيء ثنائي القطب Ion-Dipole Attractive Forces
– سيكون الشرح على هيئة اسئلة وأجوبة للتوضيح كما يلي:
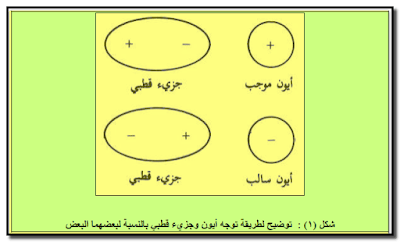
سؤال (1): كیف یتوجه أیون وجزيء قطبي لبعضھما البعض؟
الإجابة:
– عند وجود أیون – سالباً كان أو موجباً – بالقرب من جزيء قطبي فإن كلاً منھما سیتوجه بطریقة معینة تؤدي إلى تجاذبھما.
– حيث یواجه الأيون وضعاً معیناً بحیث یواجه نھایة القطب المخالفة له بالإشارة (شكل ١) .
– ولقد وجد أن قوة التجاذب الناشئة في هذه الحالة (F) تتناسب:
- طردیاً مع كل من شحنة الأیون(Q) والعزم القطبي للجزيء (μ)
- وعكسیاً مع مربع المسافة الفاصلة بین مركزي الأیون والجزيء (d2)
سؤال (2): أذكر مثال توضيحي لأثر القوى القطبية؟
الإجابة:
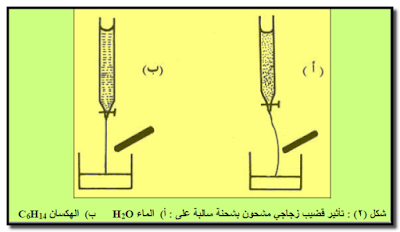
– عند حك قضیب زجاجي بقطعة من الحریر (یكتسب شحنة سالبة) ومن ثم تقریبه من تیار مائي منساب عبر سحاحة فإن تیار الماء سینحرف باتجاه القضیب ( شكل ٢ أ)
– هذا الانحراف نحو القضيب لا يحدث فيما لو أستخدم سائل الهكسان C6H14 عوضاً عن الماء (شكل ٢ ب)
سؤال (3): علل ما یحدث في الحالتین؟
الإجابة:
بسبب اتخاذ جزئيات الماء H2O (القطبية) وضعاً تكون فيها النهايات الموجبة للأقطاب باتجاه قضیب الزجاج ذي الشحنة السالبة الأمر الذي لا يحدث في حالة الھكسان لكون جزیئاته غیر قطبیة.
قوى التجاذب بين أيون وجزيء قطبي مستحث Ion-Induced Dipole Attractive Forces
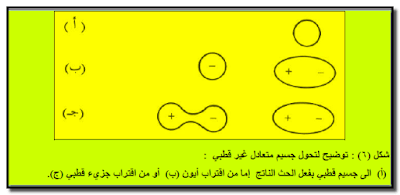
– يؤدي اقتراب أيون ما أو جزئ قطبي من جزئ أو ذرة متعادلة (أو غير قطبیة) إلى التأثیر على السحابة الإلكترونیة للجسیم غیر القطبي بحیث تكون كثافتھا حول الجسيم متفاوتة فتكون عالية فى ناحية ومنخفضة فى الناحية المعاكسة كما یتضح من الشكل (6).
– وفي كلا الحالتین فإن الجسم المتعادل وغير القطبي يكتسب الصفة القطبية عن طريق الحث مما يؤدي إلى نشوء تجاذب بين القطب المستحث والأیون (أو الجزيء القطبي) الذي قام بعملیة الحث.
سؤال (1): ما العوامل المؤثرة على قوى التجاذب فیما بین القطب المستحث والأیون ( أو الجزيء القطبي) الذي قام بعملیة الحث؟
– مقدار ھذه القوة یتناسب طردیاً مع مدى السهولة التى يمكن بها حدوث عملية الحث والتي تعتمد بدورها على المدى المتاح للسحابة الالكترونية للجسيم المتعادل غير الأيوني ليمتد تأثيرها وفعلها عليه وهو ما يسمى بقابلية الإستقطاب (Polarizability) والتي تكون عالية فى حالة الجسيمات ذات العدد الأعلى من الإلكترونات أولاً والمتمیزة بسعة انتشار سحابتھا الإلكترونیة ثانیاً.
– كذلك تتناسب عكسیاً مع القوة الرابعة للمسافة الفاصلة بین مركزي الجسمین (d4)
سؤال (2): متى تكون قابلیة الإستقطاب عالیة (Polarizability)؟
– في حالة الجسیمات ذات العدد الأعلى من الإلكترونات.
– في حالة الجسیمات المتمیزة بسعة انتشار سحابتھا الإلكترونیة.
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية.