ملخص قوانين الكيمياء الحركية
– فى هذا الموضوع سيتم مناقشة قوانين الكيمياء الحركية المتعلقة بتفاعلات الرتبة الأولى والرتبة الثانية والثالثة وكذلك فترة عمر النصف لكل منهما.
محتويات الموضوع
تعريف الكيمياء الحركية
– الكيمياء الحرارية هى أحدي فروع الكيمياء التي تهتم بدراسة سرعة التفاعل الكيميائي والعوامل المؤثرة عليه.
قانون معدل سرعة التفاعل
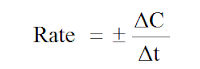
ΔC معدل التغير في التركيز المولاري (mol.l-1)
قانون سرعة التفاعل
– العلاقة بين معدل سرعة التفاعل والتركيز (علاقة طردية بين تركيز المتفاعلات ومعدل السرعة).
– فى التفاعل الآتي كما يلي:
[ ] حيث التركيز المولاري لكل مادة متفاعلة y, x رتبة التفاعل بالنسبة للمادة A , وللمادة B على التوالي
علاوة على ذلك فأن : مجموع رتب التفاعل للمواد يساوي رتبة التفاعل الكلية (n)
n = x + y
k ثابت معدل سرعة التفاعل تعتمد قيمته على درجة الحرارة وعلى الطريقة التي يعبر بها عن المعدل.
وحدات kتعتمد على قيمة رتبة التفاعل الكلية.
n هي رتبة التفاعل الكلية
حساب قانون سرعة التفاعل
تعيين قيم رتب التفاعل لكل مادة متفاعلة في قانون سرعة التفاعل كما يلي:
(1) التفاعل من الرتبة الأولى: معدل الزيادة في السرعة يساوي معدل الزيادة في التركيز
(2) التفاعل من الرتبة الثانية: إذا كانت مضاعفة التركيز مرة واحدة يصاحبها مضاعفة المعدل أربع مرات ومرتين تسع مرات.
(3) التفاعل من الرتبة الصفرية: إذا كانت الزيادة في التركيز لا تؤثر على قيمة
(4) التفاعل من الدرجة السالبة أو الكسرية يصاحبها دائماً انخفاض في قيمة السرعة مع الزيادة في التركيز.
تعريف فترة عمر النصف (t1/2)
– فترة عمر النصف هو الزمن اللازم حتى ينخفض تركيز المادة المتفاعلة إلى نصف قيمته الأولية
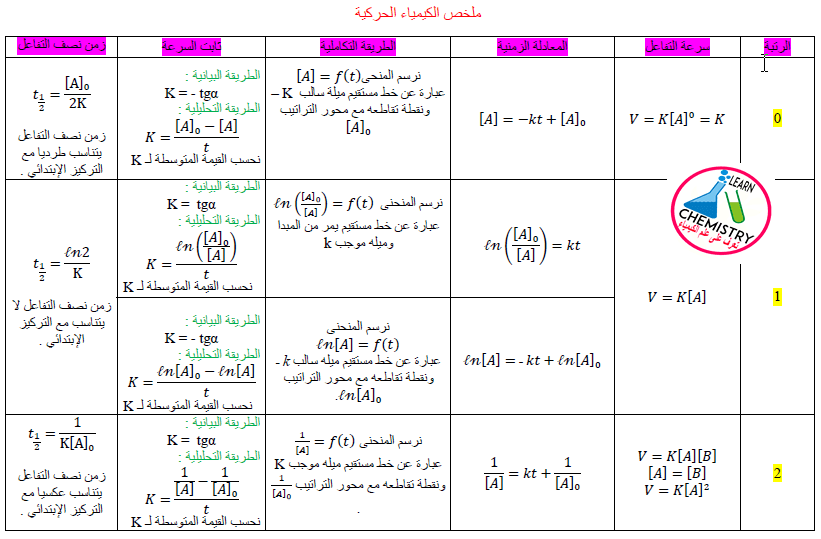
– والآن سوف نسرد لكم ملخص قوانين الكيمياء الحركية فى صور حتى تقوم بتحميلها على هاتفك وتستطيع فتحها ومراجعتها فى أى وقت وهى كما يلي:
قوانين الكيمياء الحركية
الجدول التالية توضح أهم قوانين الكيمياء الحركية كما يلي:
موضوعات متعلقة بقوانين الكيمياء الحركية
إقرأ هذه الموضوعات المهمة كما يلي: (أضغط على الموضوع الذي تريده)
(1) رتبة التفاعل Order of reaction
(2) تفاعلات الرتبة الصفرية Zero order reaction
(3) تفاعلات الرتبة الأولي First order reaction
(4) تفاعلات الرتبة الثانية Second order reaction
(5) تفاعلات الرتبة االثالثة Third order reaction
(6) طرق تعيين رتبة التفاعل Determining of Order reaction
(7) مسائل محلولة على رتبة التفاعل Solved Problems On Order reaction










Naic
اهلاً وسهلاً بك عزيزى لكم كل الحب و التقدير
شكرا
اهلاً وسهلاً بك عزيزى لكم كل الحب و التقدير
ممكن مساعدة استاذ في هذا التمرين
اذا علمت ان فترة نصف العمر للراديوم (رتبة =1) هي 3.85 يوما
أوجد النسبة المتفاعلة بالمئة℅ التركيزالابتدائي C0, وX بعد مرور 40يوما ؟