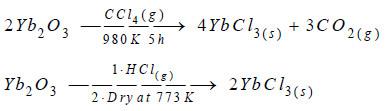الإتيربيوم Ytterbium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الإتيربيوم Ytterbium؟
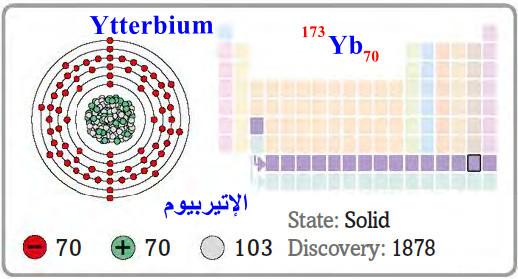
– الإتيربيوم Ytterbium هو عنصر من عناصر الجدول الدوري: العدد الذري = 70، العدد الكتلي = 173
– الرمز الكيميائي لعنصر الإتيربيوم يرمز له بالرمز: 173Yb70
– التوزيع الإلكتروني له: Xe]54 6s2 4f14]
– الإتيربيوم عنصر فلزي ينتمى إلى عناصر اللانثانيدات قابل للسحب والطرق والتشكيل لامع وفضي اللون.
– يتأكسد ببطء في الهواء.
– يتفاعل مع الماء، غباره قابل للاشتعال.
– يستعمل في التجارب المعدنية والكيميائية.
– يتم تخزينه في حاويات محكمة الغلق لمنع المعدن من التفاعل مع الأكسجين.
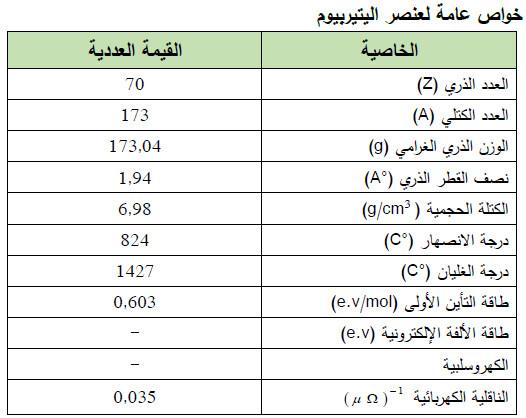
– الجدول التالي يوضح الخواص العامة لعنصر الإتيربيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Ytterbium
– اكتشف الإتيربيوم عام 1878م من قبل جين دي ماريجناك (فرنسا).
– وكان هذا الكيميائي قد حيره وآثاره تطلعه الخواص التي ظهرت على ركاز يستخرج منه الإربيوم، سمي لهذا السبب اربين.
– فتوصل الكيميائي إلى نتيجة وهي أن الركاز يحتوي على شيء آخر غير الإربيوم، وسمي العنصر على اسم Ytterby، قرية في السويد، التي دخل اسمها في أربعة عناصر: إتريوم (Y39)، تيربيوم (Tb65) اربيوم (Er68)، واتيربيوم (Yb70).
– يوجد الإتيربيـوم في المعادن مثل اليتيريا المونازايت الجادولينايت والإكزينوتايم، وهو ليس شديد الندرة، وتبلغ وفرته 2.7 جرام في الطن الواحد.
تحضير الإتيربيوم Preparation of Ytterbium
– إن دراسة الإتيربيـوم لم تبدأ بشكل عميق إلا قبل الحرب العالمية الثانية.
– يتم تحضيره من الأتربة النادرة بطريقة التبادل الأيوني، مثله مثل باقي اللانثانيدات (معادن الأتربة النادرة).
مركبات الإتيربيوم Ytterbium Compound
(1) ثاني كلوريد الإتيربيوم YbCl2
– ثاني كلوريد الإتيربيوم مركب كيميائي صنع لأول مرة سنة 1929م من قبل و. ك. كليمن و و. سشيث باختزال ثلاثي كلوريد الإتيربيـوم بواسطة الهيدروجين كما بالتفاعل التالي:
2YbCl3 + H2 → 2YbCl2 + 2HCl
(2) ثلاثي كلوريد الإتيربيوم YbCl3
– يتم تحضيره انطلاقاً من ثلاثي أكسيد الإتيربيوم كما بالتفاعلات التالية:
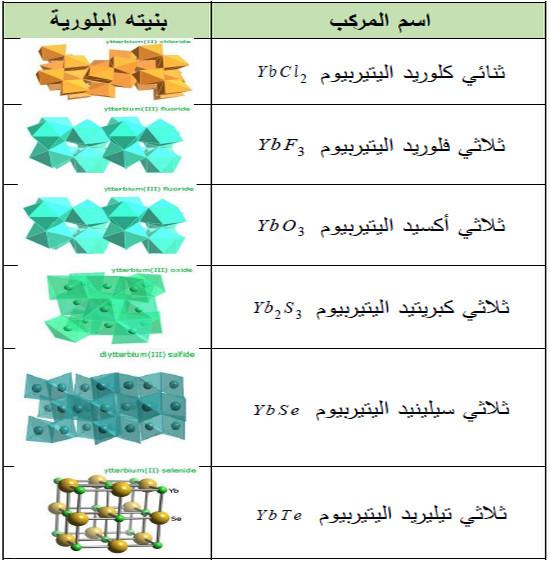
(3) مركبات أخرى
– يوجد أيضاً العديد من مركبات هذا العنصر كما بالجدول التالي:
الخواص الكيميائية لعنصر الإتيربيوم Chemical properties of Ytterbium
– يميل الإتيربيوم إلى أن يكون أكثر تفاعلاً من معادن اللانثانيدات الأخرى.
(1) التفاعل مع الهواء
– الإتيربيوم يتشوه ببطء في الهواء ويحترق بسهولة لتشكيل ثلاثي أكسيد الإتيربيوم ذو الصيغة Yb2O3 كما بالتفاعل التالي:
4Yb + 3O2 → 2Yb2O3
– لذلك يتم تخزينه في حاويات محكمة الغلق لمنع المعدن من التفاعل مع الأكسجين.
(2) التفاعل مع الماء
– يتميز الإتيربيوم بالكهروإيجابية العالية فيتفاعل ببطء مع الماء البارد وبسرعة مع الماء الساخن لتشكيل هيدروكسيد الإتيربيوم Yb(OH)3 وغاز الهيدروجين كما بالتفاعل التالي:
2Yb (s) + 6H2O (g) → 2Yb(OH)3 (aq) + 3H2 (g)
(3) التفاعل مع الهالوجينات
– الإتيربيوم المعدني يتفاعل مع كل الهالوجينات لتشكيل هاليدات الإتيربيـوم الثلاثية.
– فيتفاعل مع الفلور والكلور والبروم واليود ليشكل على التوالي محاليل بيضاء من: ثلاثي فلوريد الإتيربيوم، ثلاثي كلوريد الإتيربيـوم، ثلاثي بروميد الإتيربيـوم ثلاثي يوديد الإتيربيـوم، كما بالتفاعلات التالية:
[أبيض] 2Yb(s) + 3F2(g) → 2YbF3 (s)
[أبيض] 2Yb(s) + 3Cl2(g) → 2YbCl3 (s)
– كما يتفاعل أيضاً بنفس الطريقة مع البروم واليود.
[أبيض] 2Yb(s) + 3Br2(g) → 2YbBr3 (s)
[أبيض] 2Yb(s) + 3I2(g) → 2YbI3 (s)
(4) التفاعل مع الأحماض
– معدن الإتيربيوم يذوب بسهولة في حمض الكبريتيك المخفف لتشكيل محاليل تحتوي على أيون الإتيربيـوم الثلاثي كما بالتفاعل التالي:
2Yb (s) + 3H2SO4 (aq) → 2Yb3+ (aq) + 3SO42- (aq) + 3H2 (g)
استخدامات الإتيربيوم Uses of Ytterbium
(1) أن تستخدم في تحسين خواص الفولاذ المقاوم للصدأ.
(2) كما يستخدم في تحسين القوة الميكانيكية المستعملة في صقل الحبوب.
(3) أحد النظائر يستخدم كمصدر إشعاع كبديل لجهاز الأشعة السينية المحمولة عندما تكون الكهرباء غير متوفرة.
(4) الليزر: تستخدم مركباته في بعض أنواع الليزر حيث يمكن أن يقطع ليزر الإتيربيوم المعادن والبلاستيك.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017