الكيمياء العامةعناصر الجدول الدورى
عنصر الفلور Fluorine
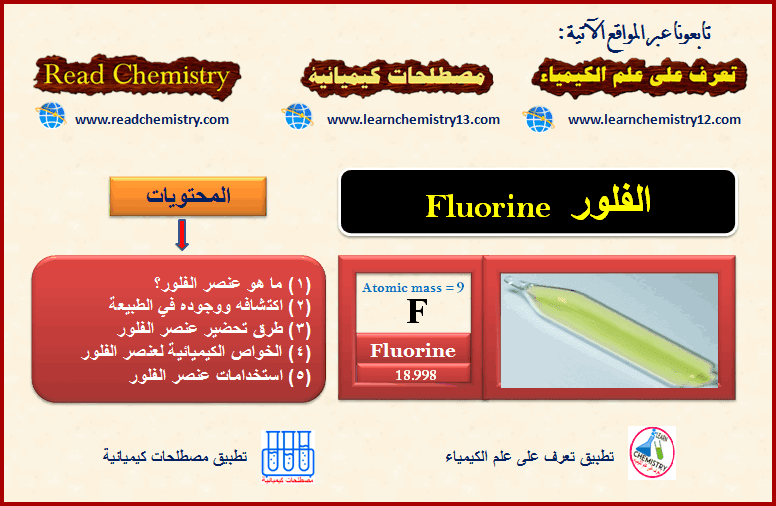
أولاً/ ما هو عنصر الفلور؟ What is Fluorine element
– الفلور عنصر من عناصر الجدول الدوري ينتمي إلى مجموعة الهالوجينات
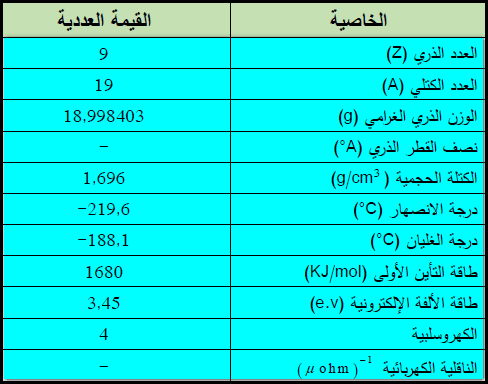
– العدد الذري للفلور = 9 والعدد الكتلي = 19
– التوزيع الإلكتروني لعنصر الفلور 1S2 , 2S2 2P5
– الفلور النقي عبارة عن غاز أصفر شاحب وهو أكثر الهالوجينات الغازية نشاطاً.

– يسبب الفلور حروقاً كيميائية شديدة عند ملامسته للجلد، حيث يكوّن مركبات بسرعة مع العناصر الأخرى.
– يتحد الفلور مع الغازات النبيلة مثل الكربتون، الرادون ، ويتفاعل الفلور بشدّة مع الهيدروجين.
– الفلور عنصر نشط لدرجة أنّه لا يوجد في حالته العنصرية وله انجذاب لمعظم الفلزات بما فيها السليكون، ولذلك لا يمكن تحضيره أو تخزينه في آنية زجاجية.
– يتفاعل الفلور بسرعة مع الماء لينتج حمض هيدروفلوريك HF شديد الخطورة.
– الجدول التالي يوضح بعض الخواص العامة لعنصر الفلور:
ثانياً/ اكتشاف الفلور ووجوده في الطبيعة Discovery of Fluorine
– عُزل الفلور من قبل مواسان Moissan في فرنسا عام 1886م وهو معروف منذ القرن السادس.
– اشتق من اللاتينية من كلمة (Fluere) بمعنى (جريان) إشارة إلى معدنه الخام CaF2 المستعمل لإسالة البقايا عند إنتاج المعادن.
– حضر لأول مرة بإمرار تيار كهربائي في خليط جاف من فلوريد الهيدروجين وفلوريد البوتاسيوم في أنبوبة على شكل حرف U من البلاتين عند -23 Co .
– يوجد الفلور بنسبة 0.1% من القشرة الأرضية وذلك في الصخور النارية.
– أهم مصادر الفلور: الفلوسبار أو فلوريد الكالسيوم CaF2 والكرايوليت أو فلوريد الصوديوم والألومنيوم Na3AlF6
ثالثاً/ تحضير عنصر الفلور Preparation of Fluorine
– الطريقة الوحيدة المتبعة لتحضير الفلور هي التحليل الكهربائي لأنه أشد العناصر المؤكسدة، حيث إن الفلور يتحد مع الماء لذا يجب أن يجري استخلاصه بشروط جافة.
– يستعمل عادة في تحضير الفلور مركب حمض الهيدروفلوريك HF الناتج من تفاعل الفلوسبار CaF2 مع حمض الكبريتيك حيث يمزج HF الجاف مع فلوريد البوتاسيوم KF لزيادة الناقلية الكهربية حيث يتفاعل هذان المركبان ويشكلان الشوارد K+ و HF2- ، تتولد الشارة HF2- نتيجة الرابطة الهيدروجينية القوية بين الشاردة F– والجزيء HF ويمكن وصف نواتج التحليل الكهربائي لمصهور KHF2 بالتفاعل النهائي التالي:
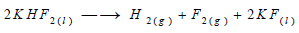
– ينطلق غاز الفلور حول المصعد وغاز الهيدروجين حول المهبط، وهذان الغازان غير قابلين عملياً للانحلال في مصهور KHF2 وهذا يسهل تجنب تفاعلهما من جديد لإعطاء مركب HF وبما أن درجة انصهار KHF2 منخفضة 35 Co لذلك من سهل إبقائه في الحالة السائلة في وعاء التحليل الذي تبلغ درجة حرارته بين 80 -100 Co نلاحظ من عملية التحليل النهائي أن المتحلل النهائي هو المركب HF لذا يجب إضافة كميات من HF دورياً إلى وعاء التحليل.
رابعاً/ الخواص الكيميائية لعنصر الفلور Chemical properties of Fluorine
(1) تفاعل الفلور مع المعادن
Reaction between Fluorine and Metals
يتفاعل الفلور مع جميع المعادن وذلك وفق التفاعل العام:
تتصف الفلوريدات المعدنية بأنها شاردية وقليلة الانحلال في الماء نسبيا فلوريدات المعادن الأساسية الترابية غير المنحلة والمعادن الشديدة الكهروايجابية، تشكل مركبات ذات طبيعة شاردية مع بقية المعادن، تكون المركبات ذات طبيعة مشتركة.
(2) تفاعل الفلور مع اللامعادن
Reaction between Fluorine and non-Metals
يتحد الفلور مع أغلب اللامعادن بسرعة ماعدا الآزوت والأكسجين وتتناقص شدة التفاعل مع لامعدن معين بازدياد العدد الذري، فمثلا يتفاعل الفلور مع الهيدروجين بانفجار حتى في الدراجات المنخفضة وفق التفاعل التالي:
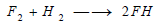
(3) تفاعل الفلور مع الماء
Reaction between Fluorine and Water
يتفاعل الفلور مع الماء فيتفكك وينطلق الأكسجين:
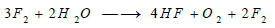
(4) تفاعل الفلور مع القواعد
Reaction between Fluorine and Bases
يتفاعل الفلور مع القواعد فيعطي الشاردة والمركب OF2 وذلك مع الأسس الباردة والممدة ويعطي الشاردة F– والأكسجين مع الأسس المركزة والساخنة حسب المعادلات:
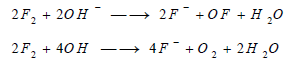
(5) تفاعل الفلور مع الهالوجينات
Reaction between Fluorine and Metals
يمكن للفلور أن يتفاعل مع الهالوجينات مشكلاَ مركبات ذات طبيعة مشتركة تدعى بالهالوجينات الداخلية ويمكن تحضيرها من التفاعل المباشر بين الهالوجينات:
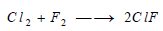
خامساً/ استخدامات عنصر الفلور Uses of Fluorine
(1) حمض الهيدروفلوريك يستخدم للحفر على الزجاج في المصابيح والمنتجات الأخرى.
(2) الفلور أحادي الذرة يستخدم في رماد البلازما في تصنيع أشباه الموصلات.
(3) يستخدم الفلور مع مركباته في إنتاج اليورانيوم.
(4) يستخدم في صناعة اللدائن التي تتحمل درجة الحرارة العادية.
(5) تستخدم مركبات الفلور والكربون أيضاً بكثرة في مكيفات الهواء وفي التبريد كما يستخدم كمبيد للحشرات وخاصة الصراصير. وقديما كان يستخدم للمساعدة في إذابة مصهور المعادن.
(6) يدخل الفلور في تركيب مينا الأسنان والبناء العظمي.
(7) يسهل الفلور امتصاص الجسم للعناصر الأخرى مثل الكالسيوم الماغنسيوم.
(8) يساعد الفلور على إبطاء هشاشة العظام.
(9) النقص في نسبة الفلور في الجسم يؤدي إلى حالات التواء العمود الفقري وتأخر التئام العظام المكسورة بالإضافة إلى تسوس الأسنان.
(10) الزيادة في نسبة الفلور في الجسم تؤدي إلى إصابة الأسنان ببقع غامقة اللّون.
(11) من أهم مصادر الفلور في غذاء الإنسان هي مشروبات الشاي وبعض أصناف المياه المعدنية والأسماك البحرية.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر





لما لا توجد الخواص الفيزيائية بوضوح
ستجد الخواص الفيزيائية فى العنصر الأول. ما هو الفلور؟