الديسبروسيوم Dysprosium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الديسبروسيوم Dysprosium؟
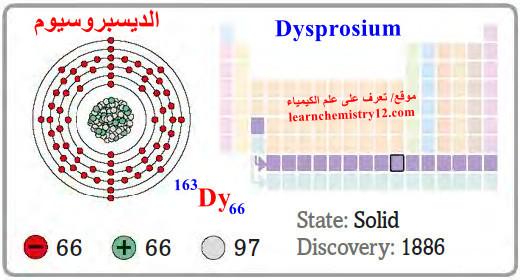
– الديسبروسيوم Dysprosium هو عنصر من عناصر الجدول الدوري: العدد الذري = 66 ، العدد الكتلي = 163
– الرمز الكيميائي لعنصر الديسبروسيوم يرمز له بالرمز: 163Dy66
– التوزيع الإلكتروني له: Xe]54 6s2 4f10]
– الديسبروسيوم هو أحد المعادن النادرة لديه لمعان كبريتيد الفضة.
– مستقر نسبياً في الهواء ودرجة حرارة الغرفة.
– يذوب بسهولة في الأحماض المعدنية ومن السهل تحليله في وجود الهيدروجين.
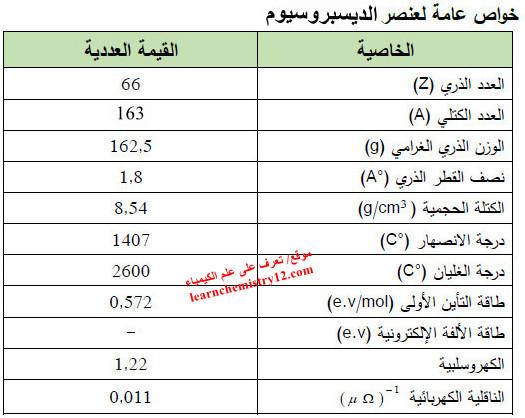
– الجدول التالي يوضح الخواص العامة لعنصر الديسبروسيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Dysprosium
– اكتشف من قبل (بول إميل ليكوك دي بواسبودران) Paul Émile Lecoq de Boisbaudran سنة 1886م في فرنسا.
– على الرغم من اكتشافه في عام 1886، فقد استغرق الأمر حتى 1950م لتنقيته.
– كما أن أصل تسمية هذا العنصر الكلمة اليونانية dysprositos والتي تعني (صعب الحصول).
– لا يتواجد الديسبروسيوم كعنصر حر في الطبيعة ولكن يعثر عليه في العديد من المعادن منها: فرکسونيت Fergusonite، أوكسينيت، مونازيت زينوتيم، وفي كثير من الأحيان مع الإربيوم والهولميوم أو اللانثانيدات الأخرى.
– حالياً معظم الديسبروسيـوم يتم الحصول عليه من الخامات الطينية في جنوب الصين.
مركبات الديسبروسيوم Dysprosium Compound
(1) تيتانات الديسبروسيوم Dy2Ti2O7
– هو مركب عضوي له نفس خصائص تيتانات الهولميوم فهو مادة تشبه الجليد.
– يكتسب الخاصية المغناطيسية في درجة حرارة منخفضة.
(2) ثلاثي كلوريد الديسبروسيوم DyCl3
– هو مركب ذو لون أبيض مصفر صلب، يمتص الماء بسرعة عند التعرض للرطوبة لتشكيل هكسا هيدرات (DyCl3.6H2O) وتسخينه يتحلل جزئياً إلى أوكسي كلوريد DyCl3
– علاوة على ذلك فهو عبارة عن حمض لويس قوي معتدل.
– محلوله المائي يستخدم لتحضير الديسبروسيوم الغير قابلة للذوبان مثل: ديسبروسيوم ثلاثي فلوريد كما التفاعل التالي:
DyCl3(aq) + 3NaF(aq) → DyF3(s) + 3NaCl(aq)
– يمكن تحضير ثلاثي كلوريد الديسبروسيـوم عن طريق تفاعل معدن الديسبروسيوم أو ثلاثي كربونات الديسبروسيـوم مع حمض الهيدروكلوريك كما بالتفاعلات التالية:
2Dy(s) + 6HCl(aq) → 2DyCl3(aq) + 3H2(g)
Dy2(CO3)3(s) + 6HCl(aq) → 2DyCl3(aq) + 3CO2(g) + 3H2O
– بالإضافة إلى ذلك يمكن استخدام ثلاثي كلوريد الديسبروسيـوم كنقطة انطلاق لإعداد أملاح الديسبروسيـوم الأخرى.
(3) ثلاثي أكسيد الديسبروسيوم Dy2O3
– هو عبارة عن مسحوق أبيض قليل النعومة.
– له استخدامات في السيراميك والزجاج وأشعة الليزر ومصابيح هاليد الديسبروسيـوم المعدني.
– يمكن أن يتفاعل مع الأحماض لإنتاج ثلاثي أملاح الديسبروسيـوم كما بالتفاعل التالي:
Dy2O3 + 6HCl → 2DyCl3 + 3H2O
(4) مركبات أخري
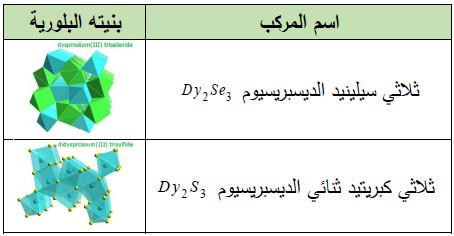
– الجدول التالي يوضح أشهر مركبات الديسبروسيـوم التي لم يتم تناولها أعلاه كما يلي:
الخواص الكيميائية لعنصر الديسبروسيوم Chemical properties of Dysprosium
(1) التفاعل مع الهواء
– كباقي اللانثانيدات يحترق الديسبروسيوم بسهولة في الهواء لتشكيل أكسيد الديسبروسيوم كما بالتفاعل التالي:
4Dy + 3O2 → 2Dy2O3
(2) التفاعل مع الماء
– يتفاعل الديسبروسيوم مع الماء لتشكيل هيدروكسيد الديسبروسيوم 3(Dy(OH كما بالتفاعل التالي:
2Dy(s) + 6H2O(g) →→ 2Dy(OH)3(aq) + 3H2(g)
(3) التفاعل مع الهالوجينات
– يتفاعل الديسبروسيـوم مع كل الهالوجينات مثله مثل باقي معادن الأتربة النادرة ليشكل هاليدات الديسبروسيـوم الثلاثية، كما بالتفاعلات التالية:
(أخضر) (s)2Dy(s) + 3F2(g) → 2DyF3
(أبيض) (s)2Dy(s) + 3Cl2(g) → 2DyCl3
– أما في حالة البروم واليود يكون كما بالتفاعلات الآتية:
(أبيض) (s)2Dy(s) + 3Br2(g) → 2DyBr3
(أخضر) (s)2Dy(s) + 3I2(g) → 2DyI3
(4) التفاعل مع الأحماض
– بما أن للديسبروسيوم عند أكسدة (+3) فإنه يتفاعل مع الأحماض لتكوين محاليل صفراء بها معقد +3[Dy(OH)2)9] كما بالتفاعل التالي:
2Dy(s) + 3H2SO4(aq) → 2Dy3+(aq) + 3SO42-(aq) + 3H2(g)
استخدامات الديسبروسيوم Uses of Dysprosium
(1) يستخدم في تطبيقات التحكم النووية لصناعة سبائك الفولاذ المقاوم للصدأ.
(2) امتصاص النيترونات.
(3) كما يستخدم لصنع مواد الليزر.
(4) يعتبر كمصدر للأشعة تحت الحمراء لدراسة التفاعلات الكيميائية.
(5) يعتبر مادة مهمة في صناعة الـ CD.
(6) علاوة على ذلك يضاف الديسبروسيوم إلى سبائك الماغنسيوم للزيادة من صلابة المواد التي تستخدم في النطاقات الجوية وتسهيل تحويلها.
(7) يمزج الديسبروسيوم مع سبائك المعادن مثل: Fe, Co, Ni, Al لصناعة المغانط الدائمة.
(8) غالبًا ما يستخدم هذا المعدن مع النيوديميوم Neodymium لإنتاج مغناطيس يستخدم في بطاريات السيارات وتوربينات الرياح والمولدات.
تأثير الديسبروسيوم على البيئة
– الديسبروسيوم له قابلية عالية على الاشتعال لذا يجب أن يحفظ في أماكن بعيدة عن اللهب المكشوف أو مصادر الاشتعال أو تراكم الشحنات الكهربائية.
– كما يجب ارتداء ملابس واقية مناسبة عند استعماله وعدم التدخين.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The periodic table book – A visual Encyclopedia of elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017