البلاديوم Palladium – الخواص الفيزيائية والكيميائية للبلاديوم
محتويات الموضوع
ما هو عنصر البلاديوم Palladium؟
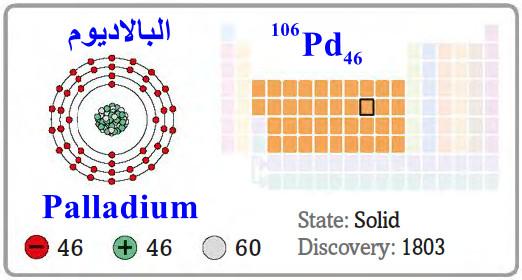
– البلاديوم Palladium هو عنصر من عناصر الجدول الدوري: العدد الذري = 46 ، العدد الكتلي = 106
– الرمز الكيميائي لعنصر البلاديوم يرمز له بالرمز: 106Pd46
– التوزيع الإلكتروني له: Kr]36 5s0, 4d10]
– البلاديوم فلز انتقالي نادر، وهو من مجموعة البلاتين يتميّز باللمعان المعدني واللون الفضي وكثافة عالية.
– له قابلية للسحب والطرق.
– يمكن الحصول عليه على هيئة مسحوق ذي دقائق صغيرة مما يجعلها عوامل حفازة نشيطة.
– يمتص البالاديوم الهيدروجين، مثل الإسفنج الذي يمتص الماء.
– يعد معدنًا نادرًا ثمينًا فهو أندر بعشر مرات من الفضة ومرتين مثل الذهب.
– يتمتع كباقي المعادن بسطح لامع ولا يتآكل بسهولة.
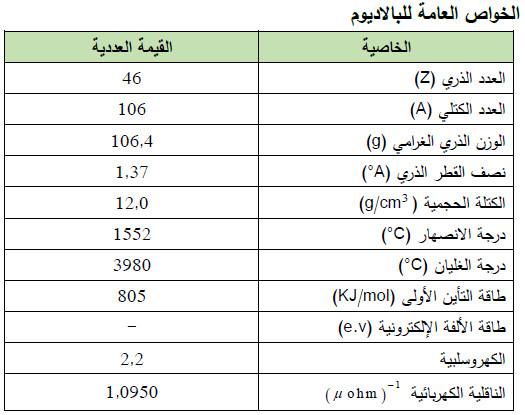
– الجدول التالي يوضح الخواص العامة لعنصر البلاديوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Palladium
– اكتشف من قبل (Wooaston) بريطاني الجنسية سنة 1803 م، اشتق اسمه من اسم النيزك Pallas لاكتشافهما في نفس الفترة.
– يشكل البلاديوم بنسبة 0.015ppm من القشرة الأرضية، فهو يوجد مع معادن البلاتين وكذلك في صورة كبريتيد أو زرنيخيد في خامات كبريتيد والنحاس والنيكل.
– كما يمكن الحصول على الشكل النقي بفصله عن خامات المعادن الأخرى، مثل النحاس والنيكل.
– تحتوي مناجم بلو ريدج الموجودة في جنوب أفريقيا على نسبة عالية من البالاديوم.
– تم العثور على البالاديوم نقيًا في الطبيعة، ولكنه يحتوي أيضًا على بعض المعادن النادرة، مثل البراغيت braggite
طرق تحضير البلاديوم Preparation of Palladium
– يتم تحضير البلاديوم من الخامات المحتوية على معادن البلاتين فبعد طحنها وتحميصها والفصل المغناطيسي لها يتم الحصول على الخام المركز الذي يعالج بالماء الملكي الذي يذيب Pd كما يلي:
Pd + 2HNO3 + 4HCl → H2PdCl4 + 2NO2 + 2H2O
– المحلول المحتوي على البالاديوم في صورة H2PdCl4 ، يضاف لها بزيادة محلول NH4OH ثم حمض HCl فيترسب المعقد Pd(NH3)2Cl2 الذي يتم حرقه للحصول على معدن البالاديوم النقي كما يلي:
Pd(NH3)2Cl2 → Pd + 2NH3 + Cl2
الخواص الكيميائية لعنصر البلاديوم Chemical properties of Palladium
(1) التفاعل مع الأكسجين
يتفاعل البلاديوم مع الأكسجين عندما يكون ساخناً إلى درجة الاحمرار كما بالمعادلة التالية:
Pd + 1/2 O2 → PdO
(2) التفاعل مع الهالوجينات
يتفاعل البلاديوم مع الهالوجينات بشكل هاليد البالاديوم كما بالمعادلة التالية:
Pd + X2 → PdX2
(3) تفاعلات أخرى
كما يتميز بقابلية امتصاص الهيدروجين (H2)، وبقابلية الذوبان ببطء في الأحماض المؤكسدة.
استخدامات البلاديوم Uses of Palladium
(1) يستخدم عاملاً حافزاً في التفاعلات الكيميائية، فمثلاً يستخدم البلاديوم في تفاعلات الهدرجة وتفاعلات نزع الهيدروجين من المركبات العضوية.
(2) يتمثل الاستخدام الرئيسي للبالاديوم في المحولات الحفازة Catalytic Converters، وهي أجهزة تستخدم في السيارات لتحويل غازات العادم السامة إلى غازات أقل ضررًا.
(3) كما يستخدم كلوريد البالاديوم في أجهزة الكشف عن أول أكسيد الكربون، التي تغير لونها عند اكتشاف أول أكسيد الكربون السام، مما يؤدي إلى إطلاق إنذار.
(4) لأن العنصر ثمين، يتم استخدامه لصنع عملات تذكارية في بعض البلدان.
(5) بالإضافة إلى ذلك فأنه يخلط مع الفولاذ لصنع سبائك أكثر مقاومة للتآكل، تستخدم هذه السبائك في صنع الأدوات الجراحية والآلات الموسيقية باهظة الثمن، مثل بعض المزامير (آلات النفخ).
(6) كما يستخدم أيضًا في شرائط اختبار الجلوكوز glucometer test strips حتى يتمكن المرضى من فحص مستوى الجلوكوز في دمائهم.
(7) غالبًا ما يتم خلط البلاديوم بالذهب لتشكيل سبيكة تسمى الذهب الأبيض، والتي تستخدم في المجوهرات.
(8) علاوة على ذلك فأن بعض أقلام الحبر تحتوي على حبيبات مزينة بالبلاديوم.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.