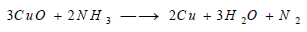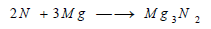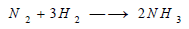النيتروجين Nitrogen – معلومات هامة جداً عن النيتروجين
أولاً/ ما هو عنصر النيتروجين؟
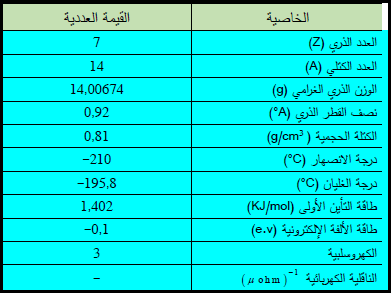
– النيتروجين عنصر من عناصر الجدول الدوري العدد الذري = 7، العدد الكتلي = 14
– التوزيع الإلكتروني لعنصر النيتروجين: 2P31S2, 2S2
– يعتبر النيتروجين من العناصر اللافلزية ويقع فى الدورة الثانية والمجموعة 15
– النيتروجيـن يعرف أيضاً باسم “الأزوت”.
– النيتروجين غاز عديم اللون والرائحة والطعم.
– والنيتروجيـن عادة غير نشيط كيميائيا يتواجد على شكل غاز في درجة الحرارة وقياس الضغط القياسيين.
– النيتروجيـن لديه خمسة إلكترونات في الغلاف الإلكتروني الخارجي وهو ثلاثي التكافؤ في معظم مركباته.
– يتكيف النيتروجين بدرجة حرارة 77 كالفن ويتجمد بدرجة حرارة 63كالفن.
– النيتروجين السائل شائع لدراسة تأثير درجات الحرارة المنخفضة على الكائنات الحية.
– يشكل النيتروجين العديد من المركبات كالأمونيا وحمض النيتريك والسيانيد.
– الجدول التالي يوضح بعض الخواص العامة لعنصر النيتروجين كما يلي:
ثانياً/ اكتشافه ووجوده في الطبيعة
– أكتشف النيتروجين من طرف كيميائي اسكتلندي دانيال راذرفورد وأسماه حينها بالهواء المضر أو الهواء المؤذي noxious air
– سماه انطوان لافوازييه باسم الآزوت azote وهي مأخوذة من كلمة لاتينيته (أزوتوس) وتعنى بلا حياة.
– أول من سماه بالنيتروجين هو العالم جان أنطوان شابتال من اللاتينية من كلمة ” نطرون” وتعنى النتر وكلمة جين وتعنى مولد أي مولد النتر ، والنتر هو المادة الكيميائية (نترات البوتاسيوم) التي كانت لازمة من أجل إنتاج حمض النتريك، والذي كان قد اكتشف أنه يحوي على غاز النتروجين.
– يشكل النيتروجين حوالي 78% من حجم الهواء الجوي أو بنسبة 75.5% بالوزن، حيث يوجد النيتروجين بنسبة ضئيلة في مياه البحار وكذلك القشرة الأرضية.
– ونظراً لاحتياج النباتات وغيرها من الكائنات الحية إلى هذا العنصر لتكوين منه البروتينات فإن النتروجين يضاف دائماً إلى التربة على هيئة بعض المركبات سهلة الذوبان في الماء مثل أملاح الأمونيوم أو النترات.
– يدخل النيتروجين في تركيب العديد من المركبات الكيميائية المنتشرة مثل نترات البوتاسيوم KNO3 ونترات الصوديوم NaNO3
ثالثاً/ تحضير النيتروجين
(1) تحضير النيتروجين من الهواء الجوي
(أ) يحضر النتروجين بإمرار تيار بطيء من الهواء فوق فلز النحاس الساخن، وبذلك يتفاعل أكسجين الهواء مع النحاس مكونا الأكسيد ويتبقى غاز النتروجين.
(ب) يمكن تحضير النتروجين بإسالة الهواء عند – 200°م وتحت الضغط ثم تقطير الهواء المسال حيث يتصاعد غاز النتروجين أولا ثم يتلوه غاز الأكسجين، والنتروجين الناتج يحتوي على القليل من بعض الغازات الخاملة التي يمكن فصلها بإعادة تجزئته.
(2) تحضير النيتروجين من مركباته
يمكن تحضير النيتروجين النقي جدا بعدة طرق منها:
(أ) تسخين مزيج من محلول نتريت الصوديوم وكلوريد الأمونيوم كما في التفاعل التالي:
(ب) من تسخين مركب أزيد الصوديوم كما في التفاعل التالي:
(جـ) بإمرار تيار من غاز النشادر فوق أكسيد النحاس الساخن كما في التفاعل التالي:
رابعاً/ الخواص الكيميائية لعنصر النيتروجين
– النتروجيـن غاز خامل لا يتفاعل مع أغلب الكواشف الكيميائية المعروفة في درجات الحرارة العادية.
– يرجع هذا الخمول إلى الثبات الكبير للرابطة الكيميائية بين ذرتي النتروجين في الجزيء N2.
(1) تفاعل ذرات النيتروجيـن النشطة مع بعض المركبات
عند تعويض الغاز تحت ضغط مخلخل إلى شرارة كهربائية يتحول نحو 2% من الغاز إلى ما يعرف باسم النتروجيـن النشيط، ويتوهج الغاز تحت هذ الظروف بوهج أصفر اللون نتيجة لتكوين بعض ذرات النتروجين المفردة وقليل من الذرات المثارة للغاز وهي الذرات التي يعزى إليها نشاط غاز النتروجيـن.
ومن أهم تفاعلاتها:
(أ) يتحد النتروجين مع بعض الفلزات مثل المغنيزيوم لتكوين نتريدات كما في التفاعل التالي:
(ب) تتحد أيضاً مع بعض الهدروكربونات مثل الإيثيلين مكونة سيانيد الهدروجين كما في التفاعل التالي:
(2) تفاعل النيتروجيـن مع الهيدروجين
يتحد غاز النيتروجين مع غاز الهيدروجين في وجود شرارة كهربائية، كما أنه يتحد معه عند إمرار خليط من كل منهما على الحديد المسخن لدرجة 500 °م تحت ضغط مرتفع ويتكون في هذه الحالات النشادر. كما في التفاعل التالي:
(3) تفاعل النيتروجيـن مع الأكسجين
يتحد النتروجين مع الأكسجين في وجود شرارة كهربائية ويتكون في هذ الحالة أكسيد النتريك ، وهو تفاعل ماص للحرارة ويعتبر هذا أساس طريقة “بير كلاند” في صناعة حمض الآزوت كما في التفاعل التالي:
(4) تفاعل النيتروجيـن مع الكربون
يتفاعل النيتروجيـن مع الكربون ويشكل السيانوجين C2N2
(5) تفاعل النيتروجيـن مع الهالوجينات
يتفاعل النيتروجيـن مع الهالوجينات ليشكل مركبات متفجرة غير ثابتة، ويتفاعل النيتروجين النقي في الدرجة 1000 °م مع كربيد الكالسيوم مشكلا سياناميد الكالسيوم كما في التفاعل التالي:
خامساً/ استخدامات عنصر النيتروجين
(1) أوسع استخدام تجاري للنتروجيـن هو كجزء في عملية تصنيع النشادر (الأمونيا) باستخدام عملية هابر، وتستخدم الأمونيا بعدها لإنتاج الأسمدة وحمض النيتريك.
(2) يستخدم النيتروجيـن كمادة غير نشطة في أجواء خزانات السوائل القابلة للانفجار. وأثناء التصنع الأجزاء الإلكترونية كالصامات الإلكترونية والديود والدوائر المتكاملة.
(3) يستخدم النيتروجيـن في صناعة الفولاذ الذي لا يصدأ.
(4) يستخدم النيتروجيـن السائل كمبرد للمنتوجات الغذائية، إما بالغمر أو لأغراض النقل لحفظ الأجسام والخلايا التكاثرية، وللتخزين الآمد للعينات الحيوية.
(5) يستخدم النيتروجيـن في دراسات حفظ الأجسام الحية.
(6) يدخل في تركيب نترات البوتاسيوم الذي يدخل في تركيب البارود ، وفي نترات الأمونيوم الذي يد ل في تركيب الأسمدة ومصبات التربة.
(7) يستخدم النيتروجيـن السائل لعلاج الأورام الجلدية خاصة الحميدة منها من أهمها الأنيلين والبيريدين.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر