الكيمياء العامةعناصر الجدول الدورى
معلومات هامة عن غاز الكلور Chlorine gas
في هذا الموضوع سوف نستعرض أهم مميزات غاز الكلور وخواصه

أولاً: ما هو عنصر الكلور؟ What is Chlorine element
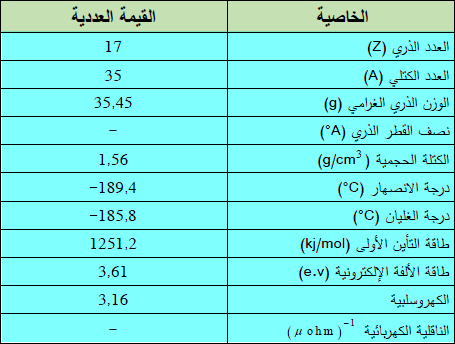
– الكلور عنصر من عناصر الجدول الدوري: العدد الذري = 17 ، العدد الكتلي = 35
– التوزيع الإلكتروني لعنصر الكلور: 1S2 , 2S2 2P6 , 3S2 , 3P5
– يكون الكلور في شكله النقي غازاً أصفر مائلا للخضرة.

– يتميز غاز الكلور برائحة خانقة و غير مستحبة.
– يتميز غاز الكلور بكثافة أكبر مرتين من كثافة الهواء.
– تحتوي ذرة الكلور على إلكترون فردي وحيد، أما جزيئاته فهي تتألف من ذرتي كلور Cl2
– يتميز هذا العنصر بنزعته لتشكيل شوارد سالبة بسيطة.
– الجدول التالي يوضح بعض الخواص العامة لعنصر الكلور:
ثانياً: اكتشاف الكلور ووجوده في الطبيعة Discovery of Chlorine
– اكتشف الكلور من قبل العالم (شيل) (Scheele)عام 1774م بالسويد.
– اشتق اسمه من اليونانية (Cloros) بمعنى أصفر مخضر للونه المشابه للون الأعشاب الصغيرة (عند بداية نموها) بمعنى أصفر مخضر للونه المشابه للون الأعشاب الصغيرة (عند بداية نموها).
– علاوة على ذلك يعد الكلور عنصراً نشيطاً جداً لا يوجد في الطبيعة غير متحد، إذ يتحد عادة مع عناصر كالصوديوم والبوتاسيوم والمغنيزيوم.
– يوجد بنسبة ضئيلة في بعض الصور النارية، كما يوجد على هيئة كلوريد الصوديوم في مياه البحار، ويوجد على هيئة رواسب من الملح في الأماكن المجاورة لبعض البحار الداخلية أو في قيعان البحيرات التي تبخرت مياهها.
ثالثاً: تحضير غاز الكلورPreparation of Chlorine
(1) يحضر الكلور مخبرياً بعدة طرق وكلها تعتمد على أكسدة شاردة الكلوريد بمادة مؤكسدة مناسبة.
والتفاعلات التالية تبين أهم هذه الطرق:
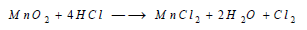
حيث يتشكل في البداية MnCl4 الذي يتفكك بالحرارة MnCl2 وغاز الكلور Cl2 ، ويمكن استعمال برمنغنات البوتاسيوم أو ثنائي كرومات الصوديوم كعوامل مؤكسدة للكلوريد:
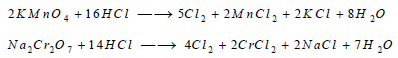
(2) يمكن تحضير الكلور بتسخين كلوريد الصوديوم مع حمض الكبريتيك في وجود ثاني أكسيد المنغنيز حسب التفاعل التالي:
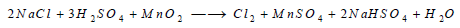
(3) يحضر الكلور صناعياً بشكل ناتج ثانوي من الاستحصال الصناعي للمعادن الفعالة مثل Na , Ca , Mg إذ
يتم في هذه العمليات التحليل الكهربائي لمصهور كلوريدات هذه المعادن وينطلق دوماً Cl2 على مصعد وعاء التحليل.
مثال ذلك:
رابعاً: الخواص الكيميائية لغاز الكلور Chemical properties of Chlorine
(1) تشابه الكلور مع غاز الأكسجين
يشبه غاز الكلور غاز الأكسجين في كثير من تفاعلاته، فهو يساعد على اشتعال كثير من المواد القابلة للاشتعال في جو من الأكسجين، فتشتعل كثير من الفلزات واللافلزات في جو من غاز الكلور مكونة الكلوريدات المقابلة لها.
(2)تفاعل الكلور مع الهيدروجين Reaction between Chlorine and Hydrogen
– يتحد غاز الكلور بغاز الهيدروجين ببطء نسبياً عند درجات الحرارة العادية، لكن خليط الغازين ينفجر عند تسخينه أو عند تعريضه لضوء الشمس المباشر.
– يلاحظ أن غاز الكلور الجاف لا يتحد بغاز الهيدروجين الجاف حتى لو عرض لضوء الشمس المباشر، والتفاعل بين الغازين طارد للحرارة.
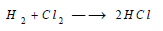
(3) تفاعل الكلور مع اللافلزات Reaction between Chlorine and non-metals
– يتحد الكلور مع كثير من اللافلزات ، فهو يتحد بالفوسفور الذي يشتعل فيه مكوناً نوعين من الكلوريد تبعا لكمية الكلور المستخدمة، أحدهما سائل وهو ثالث كلوريد الفوسفور، والآخر صلب هو خامس كلوريد الفوسفور.
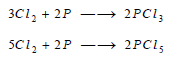
– يتفاعل غاز الكلور كذلك مع الكبريت مكوناً عدة كلوريدات أهمها:
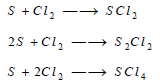
– يتحد غاز الكلور مباشرة مع السيليكون مكوناً رابع كلوريد السيليكون، ومع البورون مكوناً لثالث كلوريد البورون:
– يتفاعل غاز الكلور مباشرة مع غاز الفلور مكوناً أحادي فلوريد الكلور ClF كما يتحد بالبروم مكوناً أحادي كلوريد البروم:
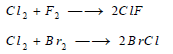
(4) تفاعل الكلور مع الفلزات Reaction between Chlorine and Metals
يتحد غاز الكلور مباشرة من أغلب الفلزات ومثال ذلك:
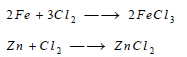
(5) تفاعل الكلور مع الماء والقواعد Reaction between Chlorine and Bases
قد يحل الكلور محل الأكسجين في الماء، وذلك عندما يذاب الكلور في قدر مكافئ من الماء، ثم يعرض المحلول بعد ذلك لضوء الشمس المباشر فيتكون كلوريد الهيدروجين وينطلق الأكسجين. والتفاعل ماص للحرارة:
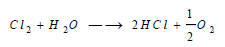
(6)تفاعل الإضافة Addition reactions
– يضاف غاز الكلور إلى بعض المركبات التي لم تستكمل تكافؤها التام، ومثال ذلك إضافة الكلور إلى أول أكسيد الكربون لتكوين كلوريد الكربونيل:
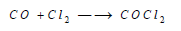
– يضاف الكلور أيضا إلى بعض الروابط غير المشبعة في بعض المركبات العضوية، مثل الايثيلين والأستيلين.
– يتفاعل الكلور أيضا مع بعض كلوريدات الفلزات ذات التكافؤ المنخفض لتحويلها إلى كلوريدات عالية التكافؤ.
ومثال ذلك:
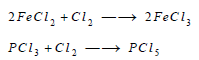
(7) تفاعلات الاستبدال Substitution reactions
– يحل الكلور محل الهيدروجين في كثير من المركبات:
ومثال ذلك تفاعل غاز الكلور مع غاز الميثان، ويتكون في هذا التفاعل كلوريد الميثيل أولا، ثم ينتهي التفاعل في وجود زيادة من غاز الكلور بتكوين رابع كلوريد الكربون.
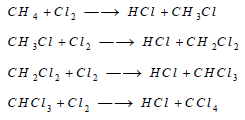
– الكلور يحل أيضا محل الهيدروجين في جزيء النشادر مكوناً ثلاثي كلوريد النتروجين، وهو مركب غير ثابت وشديد الانفجار، ولا يمكن تحضيره بالاتحاد المباشر بين الكلور والنتروجين:
– يحل الكلور أحيانا محل الأكسجين في بعض مركباته، ومثال ذلك تكوين كلوريد الكالسيوم عند تسخين كلوريد الكالسيوم لدرجة الاحمرار في وجود تيار من غاز الكلور:
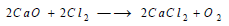
خامساً : استخدامات غاز الكلور Uses of Chlorine
يوجد الكلور عدة استخدامات صناعية وتجارية:
(1) يستخدم الكلور كمعقم، ولقد تم استخدامه لهذا الغرض ضد تشكيلة واسعة من الالتهابات المهددة للحياة وكذلك ضد الفيروسات والبكتيريا لما يزيد عن 150 عاما.
(2) يستخدم الكلور في تعقيم المياه المستخدمة لأغراض الشرب والسباحة، وفي قتل البكتيريا ذات السوية المؤذية أثناء تحضير الطعام لدى المطاعم وفي مصانع تعليب الدواجن واللحوم.
(3) يستخدم الكلور في تصنيع مساحيق التبييض ، والمنظفات المنزلية، والأصباغ والمتفجرات. والأقمشة والمواد الصيدلانية، والمطاط الصناعي والورق والمنتجات النفطية واللدائن والغازات السامة.
(4) كذلك تم استخدام الهيدروكربونات المكلورة على نطاق واسع كمبيدات حشرية.
سادساً: تأثير الكلور على جسم الإنسان
– يمكن أن يدخل الكلور إلى الجسم عن طريق تناول الطعام وشرب الماء أو حتى استنشاق الهواء.
– يعد الامتصاص المعوي المعدي من الطعام والماء المصدر الأساسي للكلور المتراكم داخلياً عند عامة الناس.
– يعد الكلور مادة ضرورية من أجل صحة الجهازين الهضمي والعصبي. وفور دخوله، يسلك الكلور- 36 في الجسم بالطريقة نفسها التي تسلكها بقية نظائر الكلور.
– يتم امتصاص معظم الكلور بشكل تام عند الامتصاص، فيتحرك بسرعة من القناة المعوية إلى مجرى الدم. ويتم بسرعة توزيع الكلور- 36 الذي يلج إلى مجرى الدم بعد الابتلاع أو الاستنشاق إلى جميع الأعضاء والأنسجة في الجسم.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.

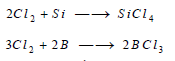
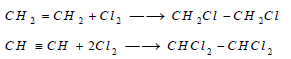
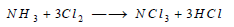




نعم دروس مفيدة
شكراً لك وأهلا وسهلاً بك فى موقعنا
معلومات قيمة بالتوفيق