الإيريديوم Iridium – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الإيريديوم Iridium؟
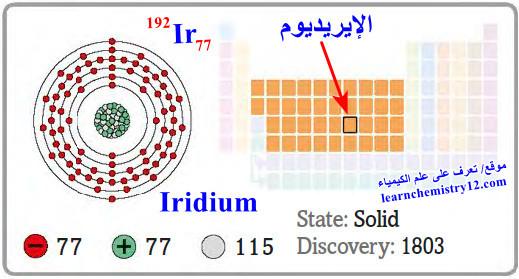
– الإيريديوم Osmium هو عنصر من عناصر الجدول الدوري: العدد الذري = 77، العدد الكتلي = 192
– الرمز الكيميائي لعنصر الإيريديوم يرمز له بالرمز: 192Ir77
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d7]
– الإريديوم فلز أبيض اللون، نادر.
– ويعد من أصلب الفلزات، مقاوم للتأكل والرطوبة.
– طبيعة هذا الفلز تجعله صامداً حتى أمام الأحماض القوية والماء في درجة حرارة اعتيادية أو في درجات حرارة مرتفعة.
– يمتاز الإريديوم عن غيره من الفلزات بأنه قادر على المحافظة دوماً على خواصه مهما تغيرت الظروف المحيطة به.
– كما أن كثافة هذا المعدن 22 مرة مثل الماء.
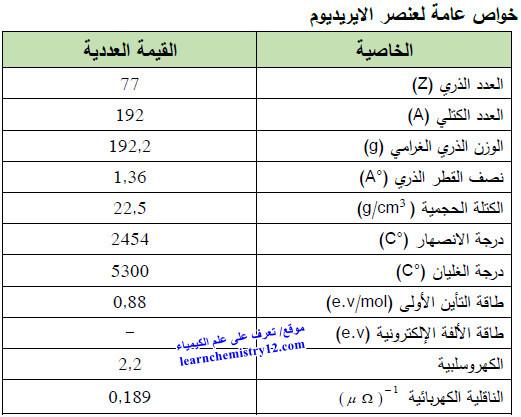
– الجدول التالي يوضح الخواص العامة لعنصر الإيريديوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Iridium
– اكتشف من قبل سميث تينانت Smithson Tennant عام 1803 م في لندن وهو كلمة يونانية الأصل تعني ألوان الطيف.
– يوجد الإريديوم في رواسب الحصباء ضمن خام البلاتين وبشكل خاص حر على هيئة حبيبات.
– الإيريديوم هو أندر العناصر الطبيعية على الأرض حيث هناك ذرة إيريديوم واحدة من بين كل مليار ذرة في صخور الأرض.
– أهم أماكن توفره جنوب إفريقيا، أمريكا الشمالية والجنوبية واليابان.
– تحتوي هذه الصخور الموجودة بالصورة على طبقة من الطين الغني بالإيريديوم.
– الإيريديوم موجود في النيازك والصخور الفضائية الأخرى حيث يحتوي نيزك Willamette meteorite الموجود في ولاية أوريغون بالولايات المتحدة الأمريكية، على 0.00047% فقط من الإيريديوم.
– يمكن العثور على هذا المعدن الكثيف في شكله النقي في الطبيعة وكذلك في الخامات الشائعة الأخرى التي تحتوي على النيكل والنحاس.
– توجد طبقة من الطين الغني بالإيريديوم في القشرة الأرضية في جميع أنحاء العالم، وخاصة في الأراضي الوعرة في ولاية داكوتا الجنوبية بالولايات المتحدة الأمريكية.
– يعتقد العلماء أن هذه الكمية الصغيرة من الإيريديوم الموجودة في قشرة كوكبنا قد ترسبت بسبب الغبار الناتج عن انفجار وقع قبل 66 مليون سنة عندما ضرب نيزك كبير كوكبنا.
تحضير الإيريديوم Preparation of Iridium
– يتم الحصول على الإريديوم من معادن البلاتين بعد إذابة pd, Au, Pt في الماء الملكي وإذابة Ag في صورة ملح النترات.
– بعد ذلك تبقى مادة صلبة غير قابلة للذوبان في الماء، يتم صهرها مع Na2O2 ثم إضافة الماء إلى الناتج الإذابة الشوائب.
– يبقى IrO2 مادة صلبة يمكن إذابتها في الماء الملكي، وتحويلها إلى معقد غير ذائب.
مركبات الإيريديوم Iridium Compounds
(أ) أكاسيد الإيريديوم Oxides Iridium
(1) أكسيد الإريديوم الثنائي IrO2
– وهو الأكسيد الوحيد المعروف للإيريديوم
– يمكن الحصول عليه بتسخين المعدن في الأكسجين أو بإضافة محلول أساسي إلى 2-(IrO2) ثم نزع الماء من الراسب الناتج.
(2) أكسيد الإيريديوم الثلاثي Ir2O3
– يمكن الحصول عليه بحرق الملح K2IrCl6 مع ملح Na2CO3.
– إلا أن هذا الأكسيد غالباً ما يكون غير نقي ويتأكسد بسرعة إلى أكسيد الإريديوم IrO2
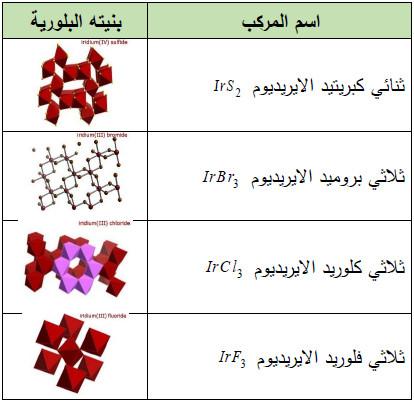
(ب) هاليدات الإريديوم Halides Iridium
(1) فلوريد الإريديوم السداسي IrF6
– يوجد في حالة صلبة، يتميز بقابليته للتطاير وعدم الثبات الحراري.
– كما يمكن تحضيره مباشرة من الفلز بتفاعله مع غاز الفلور F2
– يؤدي التحلل الحراري له إلى تكوين الفلوريد IrF3 وفق التفاعل التالي:
Ir + 3F2 → IrF6 → IrF5 +1/2 F2
(2) فلوريد الإريديوم الرباعي IrF4
– مركب أحمر اللون، يمكن تحضيره باختزال IrF5 بكمية مناسبة من الإريديوم الأسود عند درجة حرارة 400 Co كما يلي:
4IrF5 + Ir → 5IrF6
(3) هاليدات الإيريديوم الثلاثية IrX3
– أما الهاليدات IrX3 هي أكثر الهاليدات استقرارًا.
– يمكن الحصول عليها في صورة لا مائية من تفاعل الإريديوم مع الهالوجين.
– كما تتميز هذه الهاليدات بضعف فعاليتها وعدم قابليتها للذوبان في الماء.
– يمكن الحصول على الهاليدين IrBr3 وIrCl3 بتسخين الفلز مع غاز Cl2 ,Br2، أما IrF2 مع Ir.
-كذلك ند إذابة الأكسيد Ir2O3 في حمض HCl ينتج كلوريد الإريديوم المائي IrCl3.3H2O القابل للذوبان في الماء، ويعتبر هذا الملح نقطة البداية في تحضير الكثير من مركبات الإريديوم.
(جـ) مركبات أخري
كما يتواجد هذا العنصر فى مركبات أخري كما يلي:
الخواص الكيميائية لعنصر الإيريديوم Chemical properties of Iridium
(1) التفاعل مع الهواء
– لا يتفاعل الإريديوم مع الهواء في الظروف العادية، ولكن عند تسخينه مع الأكسجين فإنه يتفاعل معه كما بالمعادلة:
Ir (s) + O2 (g) → IrO2 (s)
(2) التفاعل مع الهالوجينات
– يتفاعل معدن الإيريديوم مع غاز الفلور في الظروف العادية ليعطي IrF ذو اللون الأصفر كما بالمعادلة:
Ir (s) + 3F2 (g) → IrF6 (s)
– كما يتفاعل مع كل الهالوجينات وتحت التجفيف ليعطي هاليدات الإريديوم كما بالتفاعلات التالية:
(أسود) 2Ir (s) + 3F2(g) → 2IrF3 (s)
(أحمر) 2Ir (s) + 3Cl2(g) → 2IrCl3 (s)
– كذلك يتفاعل بنفس الطريقة في حالتي البروم واليود يكون كما يلي:
(أحمر – بني) 2Ir (s) + 3Br2(g) → 2IrBr3 (s)
(أسود – بني) 2Ir (s) + 3I2(g) → 2IrI3 (s)
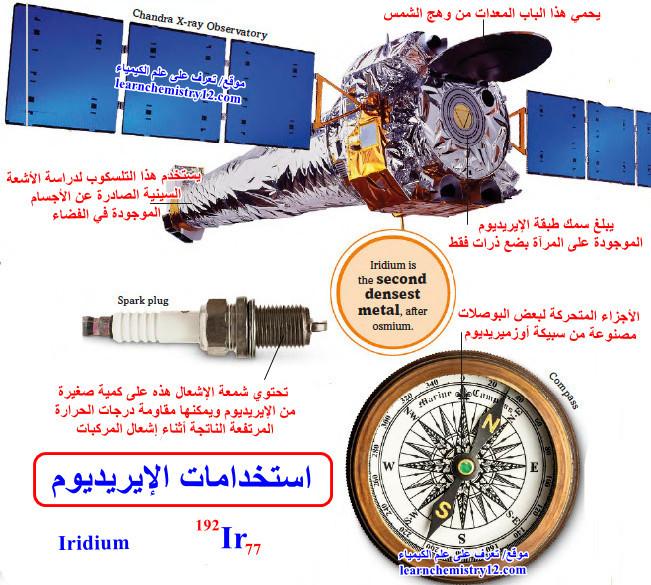
استخدامات الإيريديوم Uses of Iridium
(1) يستعمل في الصناعة الكيميائية سواء بشكل حر أو في مركبات مع فلزات أخرى فالوسائط من الإريديوم والنيكل تساعد في الحصول على البروبيلين والأسيتيلين والميثان.
(2) يستعمل في صنع المخصصة لإجراء التجارب والتفاعلات مع الفلور ومركباته العدوانية.
(3) كذلك تستعمل سبائك الإريديوم في صنع الحلي وأسنان أقلام الحبر ودعامات البوصلات الملاحية.
(4) علاوة على ذلك صنع من الإريديوم المتر المعياري محفوظ في باريس منذ 1889م.
(5) تشمل تطبيقات هذا العنصر طلاء مرآة مرصد شاندرا Chandra للأشعة السينية التابع لناسا، وهو تلسكوب يدور حول الأرض ويدرس الأشعة السينية القادمة من النجوم البعيدة.
(6) الإيريديوم أكثر متانة من البلاتين والنحاس، ولذلك فهو مفضل على هذه المعادن لاستخدامه في شمعات الإشعال.
(7) يتم أيضًا خلط الإيريديوم مع الأوسميوم لصنع سبيكة تسمى أوزميريديوم، والتي تستخدم في البوصلات وتوضع في سنان بعض أقلام الحبر لجعلها شديدة التحمل.
تأثير الإريديوم على الإنسان
– إن أملاح الإريديوم الذائبة قد تكون خطرة نوعاً ما على الإنسان.
– أما نظائره المشعة منها Ir-192 الذي يصدر إشعاعات (جاما) عالية الطاقة يمكن أن تزيد من خطر الإصابة بالسرطان، وتسبب حروق خارجية والتسمم بالإشعاع والموت.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017