الكيمياءالكيمياء العامة
قانون جاي- لوساك للحجوم المتحدة Gay-Lussac’s Law of Combining Volumes

قانون جاي- لوساك للحجوم
المتحدة
** تستخدم المعادلة الكیمیائیة التي تدل على تفاعل أو إنتاج مادتین أو أكثر في الحالة الغازیة للدلالة على أحجام الغازات التي تشارك في التفاعل وھناك علاقة بین الأحجام وبین عدد الجزیئات المشار إلیھا في المعادلة حیث یمكن تعیین الأحجام دون الرجوع إلى كتل الغازات المتفاعلة.
** ولقد
اعتبرنا في الجزء السابق أنه، عندما تخلط غازات، فإنھا لا تتفاعل مع بعضھا. ولكنھا
أحیاناً تتفاعل. فمثلاً عندما تمرر شرارة خلال خلیط من غازي الھیدروجین، والأكسجین فإن التفاعل یحدث لیكون ماء في الحالة الغازیة.
اعتبرنا في الجزء السابق أنه، عندما تخلط غازات، فإنھا لا تتفاعل مع بعضھا. ولكنھا
أحیاناً تتفاعل. فمثلاً عندما تمرر شرارة خلال خلیط من غازي الھیدروجین، والأكسجین فإن التفاعل یحدث لیكون ماء في الحالة الغازیة.

** وبالمثل فإنه عندما یعرض خلیط من الھیدروجین والكلور إلى ضوء فوق بنفسجي، فإن تفاعلاً یحدث ویتكون غاز كلورید الھیدروجین.

** ویلاحظ في أي من مثل ھذا التفاعل الذي یتضمن غازات، عند درجة حرارة وضغط ثابتین، أن الحجوم التي تتفاعل فعلاً من الغازات المنفردة تكون مضاعفات بسيطة
لبعضها البعض.
مثال توضيحي (1):
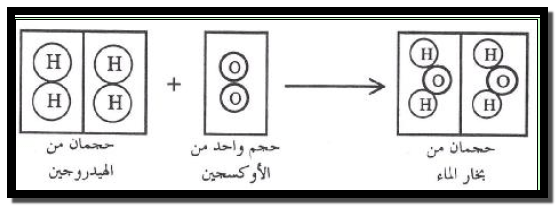
كمثال ممیز فإنه بالنسبة للتفاعل بین الھیدروجین والأكسجین لتكوين الماء يتفاعل حجمان من الهيدروجين (H2) مع
حجم واحد من الأكسجين (O2) لتكوين حجمين من بخار الماء (H2O) لتكوين حجمين من بخار الماء (H2O) كما في الشكل التالي:
حجم واحد من الأكسجين (O2) لتكوين حجمين من بخار الماء (H2O) لتكوين حجمين من بخار الماء (H2O) كما في الشكل التالي:
وتكون معادلة التفاعل كالتالي:
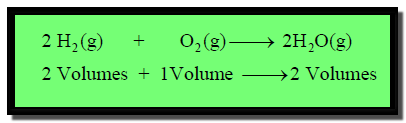
ومن السهل فهم قانون جاى – لوساك حيث
أن حجوم المواد المتفاعلة والناتجة الغازية تحدث بنفس نسب عوامل المعادلة
الموزونة. وعندما تكون وحدة الحجم هي (L) يلزم (2L) من
الهيدروجين لكل (1L) من الأكسجين لينتج (2L) من
الماء.

مثال توضيحي (2):
عند اتحاد الكلور (Cl2) مع
الھیدروجین (H2) فإن كلورید الھیدروجین (HCl) الناتج یحتوي على نفس الأعداد من ذرات الھیدروجین والكلور. وهذه الأعداد من الذرات جاءت من غازي الھیدروجین والكلور. وحسب قانون أفوجادرو فإن لھذه الأعداد من ذرات الھیدروجین أو ذرات الكلور حجوماً متساویة.
الھیدروجین (H2) فإن كلورید الھیدروجین (HCl) الناتج یحتوي على نفس الأعداد من ذرات الھیدروجین والكلور. وهذه الأعداد من الذرات جاءت من غازي الھیدروجین والكلور. وحسب قانون أفوجادرو فإن لھذه الأعداد من ذرات الھیدروجین أو ذرات الكلور حجوماً متساویة.
وفي التفاعل بین الھیدروجین والكلور، فإن كل لتر من الهيدروجین یتطلب (1L) من كلورید الھیدروجین من الكلور، ویتكون (2L) من كلورید
الھیدروجین.
الھیدروجین.

ویدعم ھذا القول قانون جاي لوساك حیث أن حجم معین من الھیدروجین یحتاج إلى نفس الحجم من الكلور كما أن ذلك یدعم القول بأن الھیدروجین یتكون من ذرات عددھا (2) أي
ثنائي الذریة، وكذلك غاز الكلور.
ثنائي الذریة، وكذلك غاز الكلور.
فلو افترضنا أن الھیدروجین أحادي الذریة وكذلك الكلور أحادي الذریة، فإن لتراً واحداً من الھیدروجین(به نفس العدد من الذرات كما ھو في الكلور) یتفاعل مع لتر واحد من الكلور والناتج ھو لتر واحد من كلورید الھیدروجین، وھذا یخالف الواقع حیث أن غاز كلورید الھیدروجین الناتج حجمه (2L) وھذا
لا یحدث إلا إذا كان الھیدروجین والكلور ثنائي الذریة، بحیث یعطي عند التفاعل (2L) من
كلورید الھیدروجین.
لا یحدث إلا إذا كان الھیدروجین والكلور ثنائي الذریة، بحیث یعطي عند التفاعل (2L) من
كلورید الھیدروجین.
مثال توضيحي(3) :
حجم واحد من النیتروجین یمكن أن یتفاعل مع ثلاثة حجوم من الھیدروجین لیكون حجمین من الأمونیا.
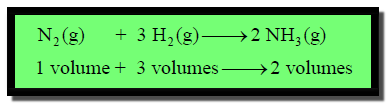
مثال توضيحي (4):
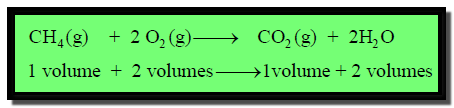
حجم واحد من المیثان یتفاعل مع) یحترق في) حجمين من الأكسجین لیعطى حجم واحد من ثاني أكسید الكربون وحجمین من البخار.
مثال توضيحي (5):
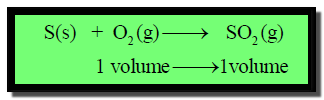
كبريت (صلب) يتفاعل مع حجم واحد من الأكسجين ليشكل حجم واحد
من ثاني أكسيد الكبريت.
من ثاني أكسيد الكبريت.
مثال توضيحي(6):
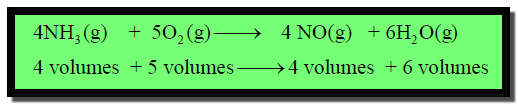
أربعة أحجام من الأمونیا تحترق في خمس حجوم من الأكسجين لينتج أربعة حجوم من
أكسید النیتریك وستة حجوم من البخار.
أكسید النیتریك وستة حجوم من البخار.
مثال توضيحي (7):
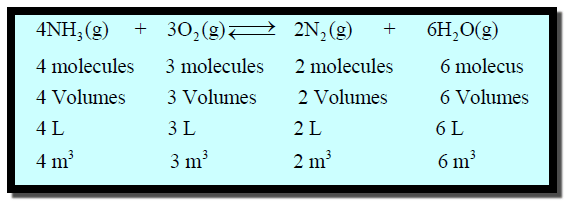
** ویجب أن نعترف أن حسابات حجم الغاز تتطلب معلومات أكثر مثل : معرفة ظروف الحرارة والضغط ) أو فرضھا( لمعرفة أي المواد موجود في حالة غازیة ، معرفة صیغ ھذه الغازات التي تدل على العدد الصحیح للذرات في جزیئات الغاز.
فمثلاً إذا قیست أحجام الغازات المتفاعلة والغازات الناتجة عن التفاعل في المعادلة السابقة عند الضغط الجوي، ولكن عند درجة
حرارة أعلى من 100Co فإن 7 وحدات
حجم من المواد المتفاعلة (4NH3 + 3O2) تؤدي
إلى الحصول على 8 وحدات حجم من المواد
الناتجة (2N2 + 6H2O) بينما عند الظروف القياسية 0Co نجد
أن 8 حجم من بخار الماء يتكثف ليشغل حجماً يمكن التغاضي عنه وقدره (0.005) بنفس
الوحدات من الماء في حالة السائل، ولذا فإن حجم (4NH3 + 3O2) تؤدي
إلى الحصول على 2 وحدات حجم (2N2)
من النواتج في الحالة الغازية.
حرارة أعلى من 100Co فإن 7 وحدات
حجم من المواد المتفاعلة (4NH3 + 3O2) تؤدي
إلى الحصول على 8 وحدات حجم من المواد
الناتجة (2N2 + 6H2O) بينما عند الظروف القياسية 0Co نجد
أن 8 حجم من بخار الماء يتكثف ليشغل حجماً يمكن التغاضي عنه وقدره (0.005) بنفس
الوحدات من الماء في حالة السائل، ولذا فإن حجم (4NH3 + 3O2) تؤدي
إلى الحصول على 2 وحدات حجم (2N2)
من النواتج في الحالة الغازية.
نص قانون جاى لوساك للحجوم المتحدة
وقد قام العالم غاي– لوساك
،
وكان مھتماً بدراسة المناطید، بدراسة المؤثرات على حجم الغاز وخواص الغازات. وقد توصل غاي – لوساك (
1809 ) إلى قانون الحجوم
المدمجة (المتحدة) أو المضافة (Combining Volumes) والذي
ینص على أنه:
،
وكان مھتماً بدراسة المناطید، بدراسة المؤثرات على حجم الغاز وخواص الغازات. وقد توصل غاي – لوساك (
1809 ) إلى قانون الحجوم
المدمجة (المتحدة) أو المضافة (Combining Volumes) والذي
ینص على أنه:
” عند ضغط ودرجة حرارة ثابتین فإن حجوم الغازات المتفاعلة والناتجة مع بعضھا البعض تكون بنسب عددیة بسیطة“
أو بعبارة أخرى :
“عند ضغط، ودرجة حرارة معینتین، فإن الغازات تتحد بنسبة بسيطة من حيث الحجم، ويحمل
حجم أى منتج غازي نسبة عددية صحيحة لذلك الخاص بأي غاز متفاعل”
حجم أى منتج غازي نسبة عددية صحيحة لذلك الخاص بأي غاز متفاعل”
At constant temperature and pressure, the volumes of
reacting gases can be expressed as a ratio of simple whole numbers.
reacting gases can be expressed as a ratio of simple whole numbers.
مسائل محلولة على قانون جاي لوساك للحجوم المتحدة
مثال (1): ما هو حجم الأكسجين (STP)
اللازم لاحتراق 4.5 dm3 من
البيوتان C4H10
احتراقاً كاملاً عند STP؟
اللازم لاحتراق 4.5 dm3 من
البيوتان C4H10
احتراقاً كاملاً عند STP؟
(البيوتان هو الوقود المستعمل في ولاعة السجائر)
الحل:
نكتب معادلة كيميائية متوازنة:
2C4H10
+13O2 → 8CO2 + 10H2O
+13O2 → 8CO2 + 10H2O
ومن الحجم المولاري فإن:

مثال (2): يحتوي منظف مصاريف المياه
“درانو” قطعاً صغیرة من الألومنیوم الذي یتفاعل مع NaOH (المكون الرئیس لھذا الصنف) لینتج فقاعات من الھیدروجین. ویفترض أن ھذه الفقاعات قد صممت لإثارة المزیج والإسراع في تأثیره. ما ھو حجم الهيدروجين cm3 عند STP الذي سيتم إطلاقه عند إذابة 0.15g من Al علماً بأن الكتلة الذرية لمول من Al = 27g/mol
“درانو” قطعاً صغیرة من الألومنیوم الذي یتفاعل مع NaOH (المكون الرئیس لھذا الصنف) لینتج فقاعات من الھیدروجین. ویفترض أن ھذه الفقاعات قد صممت لإثارة المزیج والإسراع في تأثیره. ما ھو حجم الهيدروجين cm3 عند STP الذي سيتم إطلاقه عند إذابة 0.15g من Al علماً بأن الكتلة الذرية لمول من Al = 27g/mol
الحل:
معادلة التفاعل:
2Al + 2OH– + 2H2O
→ 3H2 ↑ + 2AlO2–
→ 3H2 ↑ + 2AlO2–

المراجع
– أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية